|
|
Клетки кожи стали клетками мозга в один ход
Обычно, превращая одну клетку в другую, биологи проводят её через стволовое состояние. Но можно осуществить такое превращение и без стволовой стадии, если использовать один из молекулярных механизмов контроля генетической активности.
Клетки разных типов можно превращать друг в друга, но все методы, которые позволяют это делать, предполагают стадию искусственных, или индуцированных, плюрипотентных стволовых клеток. Если не вдаваться в подробности, процедура выглядит так: зрелую, специализированную клетку обрабатывают неким молекулярным коктейлем, меняющим активность её генов. В результате она возвращается в «детство», то есть в эмбриональное состояние, когда у неё ещё не было никакой специальной функции, но зато она могла дать начало клеткам абсолютно любого типа. Затем получившейся стволовой клетке дают новые молекулярные инструкции, направляющие её по новому пути специализации. С помощью такого метода можно получать, например, нейроны из соединительнотканных фибробластов.
Однако, как оказалось, можно пойти более коротким путём и обойтись в превращении без стволового этапа. Матеус Виктор ( Matheus B. Victor ) и его коллеги из Вашингтонского университета в Сент-Луисе (США) напрямую превратили человеческие фибробласты из кожи в нейроны, и сделали это с помощью малых регуляторных РНК. Как известно, все клетки нашего организма содержат одну и та же ДНК, отличия же их друг от друга обусловлены тем, что клеточная ДНК работает не вся, а избирательно: в нервной ткани активны одни гены, в коже - другие. Значит, есть какие-то архивирующие механизмы, не позволяющие ненужным генам активничать. Архивация обычно выглядит как плотная упаковка тех или иных областей ДНК, так что они становятся недоступны для молекулярных машин, синтезирующих РНК. Ранее исследователи выяснили, что на упаковку ДНК сильнейшим образом влияют микрорегуляторные РНК (микрорегуляторные РНК сами никаких белков не кодируют, но зато влияют на активность других генов). Две из них, miR-9 и miR-124, способствовали распаковке участков ДНК, необходимых для развития нейронов и их функционирования.
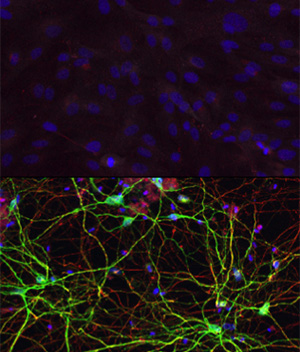
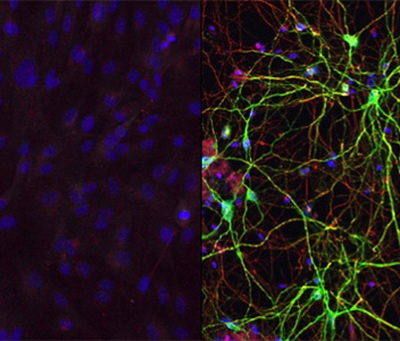
Если клетки кожи снабжали miR-9 и miR-124, то они превращались в нервные клетки разного типа. Но, если сюда подключали ещё некоторые транскрипционные факторы (белки, отвечающие за синтез тех или иных РНК), то получали уже нейроны определённой разновидности. В статье в Neuron авторы работы описывают, как им удалось превратить фибробласты кожи в средние шипиковые нейроны из полосатого тела мозга, участвующие в контроле движений. Новые клетки и внешне (по морфологии), и внутренне (по молекулярному составу и активности генов) были неотличимы от «истинных» нейронов, и после пересадки в мышь они смогли установить контакт с нужными зонами мозга, оставаясь живыми и функционирующими на протяжении как минимум шести месяцев.
Те нервные клетки, которые удалось получить, первыми реагируют на синдром Хантингтона. Аномалии в них ведут к появлению неконтролируемых движений, что является одним из главных признаков болезни. Поэтому сейчас исследователи хотят повторить ту же операцию, но с клетками кожи больных людей: после превращения в клетках проявятся «хантингтоновые» генетические аномалии, и, пересадив полученные нейроны в мозг, можно будет наблюдать развитие болезни в условиях, максимально близких к естественным. (Правда, всё равно придётся учитывать тот факт, что больные человеческие нейроны будут сидеть в животном мозге.) То же самое можно проделать и для других психоневрологических заболеваний, возникающих ввиду каких-то генетических неполадок.
 Метод прямого перепрограммирования с помощью регуляторных РНК и набора транскрипционных факторов может сильно упростить клеточные манипуляции: превращение идёт в один этап, и можно сразу получить клетку не просто нужного типа, но и нужной разновидности. Стоит подчеркнуть, что речь идёт о человеческих клетках, причём о довольно разных - всё-таки нейроны сильно отличаются от фибробластов. Год назад похожую работу выпускали исследователи из Калифорнийского университета в Санта-Барбаре (США), но они работали с клетками нематоды, и превращение шло между относительно близкими клеточными видами: клетки глотки превращали в клетки кишечника. Тогда же высказывались сомнения в том, что такое изменение специализации «в один ход» удастся совершить с сильно непохожими друг на друга клетками; однако, как видим, сомнения эти удалось успешно разрешить. Метод прямого перепрограммирования с помощью регуляторных РНК и набора транскрипционных факторов может сильно упростить клеточные манипуляции: превращение идёт в один этап, и можно сразу получить клетку не просто нужного типа, но и нужной разновидности. Стоит подчеркнуть, что речь идёт о человеческих клетках, причём о довольно разных - всё-таки нейроны сильно отличаются от фибробластов. Год назад похожую работу выпускали исследователи из Калифорнийского университета в Санта-Барбаре (США), но они работали с клетками нематоды, и превращение шло между относительно близкими клеточными видами: клетки глотки превращали в клетки кишечника. Тогда же высказывались сомнения в том, что такое изменение специализации «в один ход» удастся совершить с сильно непохожими друг на друга клетками; однако, как видим, сомнения эти удалось успешно разрешить.
Подробнее см.: http://www.nkj.ru/news/25085/ (Наука и жизнь, Клетки кожи стали клетками мозга в один ход)
NeuroResource
Generation of Human Striatal Neurons by MicroRNA-Dependent Direct Conversion of Fibroblasts
- Matheus B. Victor1, 2, 6,
- Michelle Richner1, 6,
- Tracey O. Hermanstyne1, 3,
- Joseph L. Ransdell1, 3,
- Courtney Sobieski2, 4,
- Pan-Yue Deng5,
- Vitaly A. Klyachko5,
- Jeanne M. Nerbonne1, 3,
- Andrew S. Yoo1, ,
- 1 Department of Developmental Biology, Washington University School of Medicine, Saint Louis, MO 63110, USA
- 2 Program in Neuroscience, Washington University School of Medicine, Saint Louis, MO 63110, USA
- 3 Center for Cardiovascular Research, Washington University School of Medicine, Saint Louis, MO 63110, USA
- 4 Department of Psychiatry, Washington University School of Medicine, Saint Louis, MO 63110, USA
- 5 Departments of Biomedical Engineering and Cell Biology and Physiology, CIMED, Washington University, Saint Louis, MO 63110, USA
- Accepted 6 October 2014, Available online 22 October 2014
Highlights
- •
-
Striatal transcription factors with miRNAs robustly converts human fibroblasts to MSNs
- •
-
Converted cells show a gene expression profile analogous to primary human MSNs
- •
-
Transplanted MSNs converted from human fibroblasts can function in vivo
- •
-
Engrafted cells wire into the circuit properly and are capable of long-term survival
Summary
The promise of using reprogrammed human neurons for disease modeling and regenerative medicine relies on the ability to induce patient-derived neurons with high efficiency and subtype specificity. We have previously shown that ectopic expression of brain-enriched microRNAs (miRNAs), miR-9/9∗ and miR-124 (miR-9/9∗-124), promoted direct conversion of human fibroblasts into neurons. Here we show that coexpression of miR-9/9∗-124 with transcription factors enriched in the developing striatum, BCL11B (also known as CTIP2), DLX1, DLX2, and MYT1L, can guide the conversion of human postnatal and adult fibroblasts into an enriched population of neurons analogous to striatal medium spiny neurons (MSNs). When transplanted in the mouse brain, the reprogrammed human cells persisted in situ for over 6 months, exhibited membrane properties equivalent to native MSNs, and extended projections to the anatomical targets of MSNs. These findings highlight the potential of exploiting the synergism between miR-9/9∗-124 and transcription factors to generate specific neuronal subtypes.
-------------------
Human skin cells reprogrammed directly into brain cells
October 22, 2014
By Julia Evangelou Strait
DANIEL ABERNATHY
Andrew Yoo, PhD, (from left) Michelle Richner, Matheus Victor and their colleagues described a way to convert human skin cells directly into medium spiny neurons, a type of brain cell affected by Huntington’s disease. Scientists have described a way to convert human skin cells directly into a specific type of brain cell affected by Huntington’s disease, an ultimately fatal neurodegenerative disorder. Unlike other techniques that turn one cell type into another, this new process does not pass through a stem cell phase, avoiding the production of multiple cell types, the study’s authors report.
The researchers, at Washington University School of Medicine in St. Louis, demonstrated that these converted cells survived at least six months after injection into the brains of mice and behaved similarly to native cells in the brain.
"Not only did these transplanted cells survive in the mouse brain, they showed functional properties similar to those of native cells," said senior author Andrew S. Yoo, PhD, assistant professor of developmental biology. "These cells are known to extend projections into certain brain regions. And we found the human transplanted cells also connected to these distant targets in the mouse brain. That’s a landmark point about this paper."
The work appears Oct. 22 in the journal Neuron.
The investigators produced a specific type of brain cell called medium spiny neurons, which are important for controlling movement. They are the primary cells affected in Huntington’s disease, an inherited genetic disorder that causes involuntary muscle movements and cognitive decline usually beginning in middle-adulthood. Patients with the condition live about 20 years following the onset of symptoms, which steadily worsen over time.
The research involved adult human skin cells, rather than more commonly studied mouse cells or even human cells at an earlier stage of development. In regard to potential future therapies, the ability to convert adult human cells presents the possibility of using a patient’s own skin cells, which are easily accessible and won’t be rejected by the immune system.
To reprogram these cells, Yoo and his colleagues put the skin cells in an environment that closely mimics the environment of brain cells. They knew from past work that exposure to two small molecules of RNA, a close chemical cousin of DNA, could turn skin cells into a mix of different types of neurons.
In a skin cell, the DNA instructions for how to be a brain cell, or any other type of cell, is neatly packed away, unused. In past research published in Nature, Yoo and his colleagues showed that exposure to two microRNAs called miR-9 and miR-124 altered the machinery that governs packaging of DNA. Though the investigators still are unraveling the details of this complex process, these microRNAs appear to be opening up the tightly packaged sections of DNA important for brain cells, allowing expression of genes governing development and function of neurons.
Knowing exposure to these microRNAs alone could change skin cells into a mix of neurons, the researchers then started to fine tune the chemical signals, exposing the cells to additional molecules called transcription factors that they knew were present in the part of the brain where medium spiny neurons are common.
YOO LAB
Human skin cells (top) can be converted into medium spiny neurons (bottom) with exposure to the right combination of microRNAs and transcription factors, according to work by Andrew Yoo and his research team. "We think that the microRNAs are really doing the heavy lifting," said co-first author Matheus B. Victor, a graduate student in neuroscience. "They are priming the skin cells to become neurons. The transcription factors we add then guide the skin cells to become a specific subtype, in this case medium spiny neurons. We think we could produce different types of neurons by switching out different transcription factors."
Yoo also explained that the microRNAs, but not the transcription factors, are important components for the general reprogramming of human skin cells directly to neurons. His team, including co-first author Michelle C. Richner, senior research technician, showed that when the skin cells were exposed to the transcription factors alone, without the microRNAs, the conversion into neurons wasn’t successful.
The researchers performed extensive tests to demonstrate that these newly converted brain cells did indeed look and behave like native medium spiny neurons. The converted cells expressed genes specific to native human medium spiny neurons and did not express genes for other types of neurons. When transplanted into the mouse brain, the converted cells showed morphological and functional properties similar to native neurons.
To study the cellular properties associated with the disease, the investigators now are taking skin cells from patients with Huntington’s disease and reprogramming them into medium spiny neurons using the approach described in the new paper. They also plan to inject healthy reprogrammed human cells into mice with a model of Huntington’s disease to see if this has any effect on the symptoms.
This work was supported by the National Science Foundation Graduate Research Fellowship (DGE-1143954), the fellowship from Cognitive, Computational and Systems Neuroscience Pathway (T32N5023547), and grants from the National Institutes of Health (NIH) (MH078823), including from the National Institute of General Medical Sciences (R01 GM104991) and the National Heart Lung and Blood Institute (T32 HL007275), the NIH Director’s Innovator Award (DP2) and awards from the Mallinckrodt Jr. Foundation, Ellison Medical Foundation, and Presidential Early Career Award for Scientists and Engineers.
Victor MB, Richner M, Hermanstyne TO, Ransdell JL, Sobieski C, Deng PY, Klyachko VA, Nerbonne JM, Yoo AS. Generation of human striatal neurons by microRNA-dependent direct conversion of fibroblasts. Neuron. Oct. 22, 2014. Washington University School of Medicine’s 2,100 employed and volunteer faculty physicians also are the medical staff of Barnes-Jewish and St. Louis Children’s hospitals. The School of Medicine is one of the leading medical research, teaching and patient-care institutions in the nation, currently ranked sixth in the nation by U.S. News & World Report. Through its affiliations with Barnes-Jewish and St. Louis Children’s hospitals, the School of Medicine is linked to BJC HealthCare.
|

 Метод прямого перепрограммирования с помощью регуляторных РНК и набора транскрипционных факторов может сильно упростить клеточные манипуляции: превращение идёт в один этап, и можно сразу получить клетку не просто нужного типа, но и нужной разновидности. Стоит подчеркнуть, что речь идёт о человеческих клетках, причём о довольно разных - всё-таки нейроны сильно отличаются от фибробластов. Год назад похожую работу выпускали исследователи из Калифорнийского университета в Санта-Барбаре (США), но они работали с клетками нематоды, и превращение шло между относительно близкими клеточными видами: клетки глотки превращали в клетки кишечника. Тогда же высказывались сомнения в том, что такое изменение специализации «в один ход» удастся совершить с сильно непохожими друг на друга клетками; однако, как видим, сомнения эти удалось успешно разрешить.
Метод прямого перепрограммирования с помощью регуляторных РНК и набора транскрипционных факторов может сильно упростить клеточные манипуляции: превращение идёт в один этап, и можно сразу получить клетку не просто нужного типа, но и нужной разновидности. Стоит подчеркнуть, что речь идёт о человеческих клетках, причём о довольно разных - всё-таки нейроны сильно отличаются от фибробластов. Год назад похожую работу выпускали исследователи из Калифорнийского университета в Санта-Барбаре (США), но они работали с клетками нематоды, и превращение шло между относительно близкими клеточными видами: клетки глотки превращали в клетки кишечника. Тогда же высказывались сомнения в том, что такое изменение специализации «в один ход» удастся совершить с сильно непохожими друг на друга клетками; однако, как видим, сомнения эти удалось успешно разрешить.