|
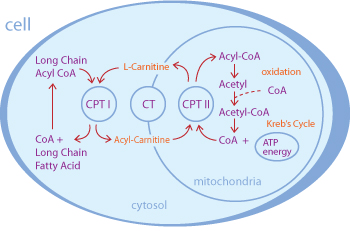
Рисунок 1. Участие L-карнитина в транспорте жирных кислот из цитоплазмы в митохондрию для β-окисления и получения энергии. CPT - карнитин-пальмитоилтрансфераза, CT - карнитин-ацилкарнитинтранслоказа, CoA - кофермент A. Думайте, что покупаете!
Впервые L-карнитин был выделен двумя русскими учеными в 1905 году. Следовательно, сейчас идет уже второй век с момента открытия и начала изучения роли этой молекулы в организме человека [2]. Это один и самых исследуемых компонентов пищи. Пища, а именно красное мясо - основной источник карнитина у всеядных животных; тем не менее, немного L-карнитина синтезируется из лизина и в самом организме.
Кроме того, все больше и больше людей потребляет L-карнитин в качестве пищевых добавок. Помимо интернет-магазинов, магазинов спортивного питания и аптек, карнитин стал встречаться даже на полках продуктовых магазинов нашей страны, в том числе и в составе витаминов, энергетических напитков, шоколадных батончиков и прочего. Купить L-карнитин или продукты с его содержанием может кто угодно. В большинстве случаев L-карнитин принимают, видимо, в надежде интенсифицировать разрушение жиров, так как считается, что он осуществляет транспорт жирных кислот в митохондриальный матрикс, где происходит их разрушение с выделением энергии (рис. 1).
Реклама L-карнитина обещает быстрое похудение, увеличение мышечной массы, улучшение умственной и физической формы, устойчивости к стрессу, детоксикацию организма и многое другое. Надо сказать, что многие положительные эффекты карнитина действительно научно доказаны, но не стоит забывать о том, что до сих пор неизвестно, вреден ли избыток карнитина для здоровья.
Норма потребления L-карнитина для взрослого человека составляет 300 мг, тогда как для похудения и улучшения спортивных показателей оптимальными считаются дозы от 500 мг до 2 г в сутки. В надежде же обрести идеальное тело, прилагая при этом минимум усилий, люди в несколько раз превышают норму, не задумываясь о возможных последствиях. А зря. Ведь мы знаем, что метаболические пути в организме недостаточно изучены, и что практически все лекарства - да что там, даже витамины при их чрезмерном употреблении - имеют побочные действия. И L-карнитин не является исключением! Исследования 2013 года показали, что метаболит L-карнитина - триметиламин оксид (ТМАО) - вещество, способствующее развитию атеросклероза [3].
Коварные бактерии, или новый взгляд на метаболизм L-карнитина
Задуматься о возможной связи L-карнитина с развитием атеросклероза заставило открытие 2011 года, показавшее связь метаболизма холина - структурного аналога L-карнитина - с патогенезом сердечнососудистых заболеваний [3]. Главным источником холина служит фосфатидилхолин - одна из самых распространенных молекул клеточных мембран, в больших количествах содержащаяся пище животного происхождения.
Как оказалось, холин используется некоторыми кишечными бактериями для синтеза интермедиата триметиламина (ТМА) (рис. 2). В свою очередь, ТМА быстро абсорбируется и окисляется ферментами семейства FMO (флавинмонооксигеназа, FMO3 - главный фермент процесса) в печени до ТМАО, вызывающего развитие атеросклероза.
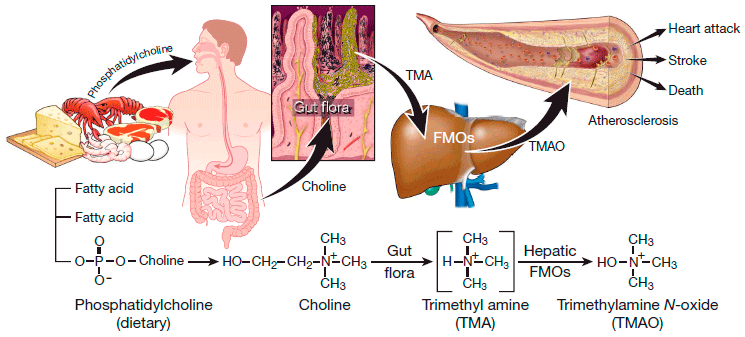
Рисунок 2. Схема синтеза кишечной флорой метаболита фосфатидилхолина, стимулирующего развитие атеросклероза [3]. Фосфатидилхолин служит источником холина, который некоторые бактерии кишечника способны использовать для синтеза ТМА. ТМА, в свою очередь, быстро преобразуется ферментом флавинмонооксигеназой в ТМАО, уровень которого показал строгую корреляцию с развитием атеросклероза. Использование бактериями триметиламинной группы холина для синтеза ТМА поднимает вопрос о существовании подобных метаболических путей для аналогичных соединений, включающих эту группу. Одна из таких молекул - как раз карнитин (рис. 3). Возникшее предположение о связи продукции ТМАО из L-карнитина подтвердилось исследованиями 2013 года [1], хотя предшествующие эксперименты на крысах не выявляли такой связи [4].
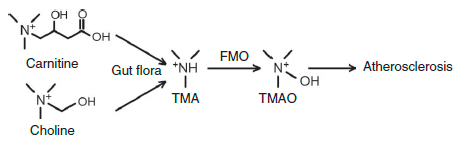
Рисунок 3. Схема синтеза ТМАО, приводящего к развития атеросклероза [1]. Карнитин и холин - триметиламины, получаемые с пищей, - используются для синтеза ТМА микрофлорой кишечника, который быстро окисляется флавинмонооксигеназой до ТМАО. 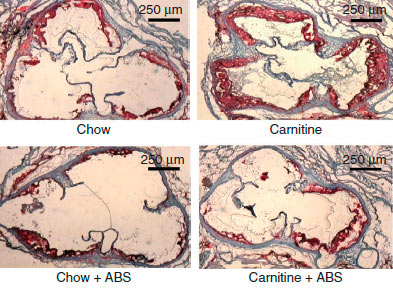
Рисунок 4. Срезы корней аорты 19-недельных мышей [1]. Окраска гематоксилином. Chow - нормальное питание, ABS - отсутствие антибиотика. Метаболит L-карнитина - одна из причин развития сердечнососудистых заболеваний
Два независимых клинических исследования показали связь концентрации L-карнитина и ТМАО в плазме крови с развитием коронарной и периферической недостаточностей, а также сердечнососудистых заболеваний в целом. В первом исследовании участвовала группа из 2595 человек [1], во втором - проводился трехлетний кардиологический контроль 4000 пациентов [5].
Исследования на мышах также подтверждают корреляцию высокого уровня L-карнитина и ТМАО с развитием патологий сердечнососудистой системы [1]. С четырехнедельного возраста четыре группы мышей получали питание определенного типа: 1) обычное, 2) с повышенным содержанием карнитина, 3) с добавлением антибиотиков или 4) с повышенным содержанием карнитина и добавлением антибиотиков. Сравнение ткани корней аорты у мышей по достижении 19-недельного возраста выявило двойное увеличение области атеросклеротического повреждения при добавлении L-карнитина в корм (рис. 4, 5 А ). У мышей, получающих L-карнитин в комплексе с антибиотиками, нарушений не возникало. Следовательно, виновники развития сердечнососудистых нарушений - бактерии, участвующие в образовании ТМАО, уровень которого значительно возрастает при потреблении L-карнитина (рис. 5 Б ) и коррелирует с развитием атеросклероза.
Вспомним про веганов (радикальные вегетарианцы, не употребляющие никаких продуктов животного происхождения) и вегетарианцев, не употребляющих красное мясо с высоким содержанием L-карнитина,и задумаемся, есть ли у них в кишечнике группа бактерий, ответственная за образование ТМА, окисляющегося до ТМАО (рис. 3)?
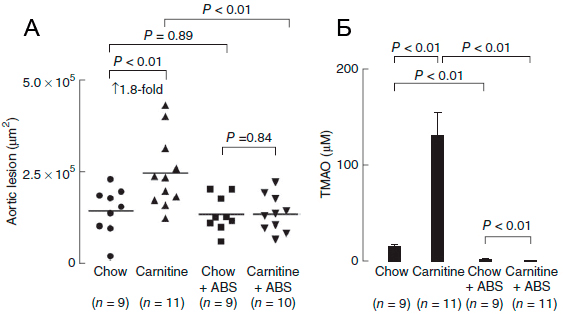
Рисунок 5. А. Оценка площади атеросклеротического повреждения корней аорты у мышей в зависимости от типа питания. Б. Зависимость уровня ТМАО от типа питания мышей [1]. Chow - нормальное питание, ABS - отсутствие антибиотика. Не секрет, что пищевые предпочтения определяют состав микробиоты [6]. Так, продолжительный избыток карнитина в пище приводит к изменениям состава флоры кишечника, способствуя процветанию бактерий, участвующих в синтезе ТМАО [1] . Сниженное потреблениеL-карнитина и холина у веганов и вегетарианцев, напротив, не дает им развиваться. Бактерий, синтезирующих ТМАО, практически не остается, и даже при включении L-карнитина в рацион людей, длительное время соблюдающих растительную диету, уровень ТМАО в плазме крови и моче остается низким (рис. 6).
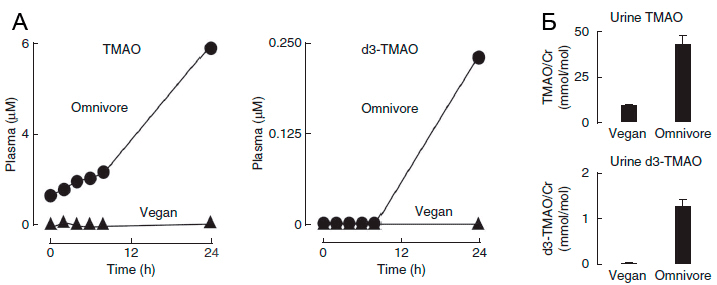
Рисунок 6. Сравнение уровней ТМАО в плазме крови (А) и в моче (Б) после приема L-карнитинау веганов и людей, практически ежедневно потребляющих продукты из красного мяса [1]. Синтез ТМАО (или его d3-меченного аналога) после потребления мясного стейка и L-карнитина (или d3-метил карнитина) незначителен у веганов (больше 5 лет отказывающихся от животных продуктов), в отличие от людей, регулярно потребляющих красное мясо. Полученные данные были дополнительно проверены и подтверждены на людях, следующих обычной диете, и людях, ведущих веганский или вегетарианский образ жизни более года. Из этого можно предположить, что низкий уровень ТМАО и есть основная причина хорошего состояния сердечнососудистой системы веганов и вегетарианцев. Ведь статистика показывает нам более редкую встречаемость сердечнососудистых заболеваний [7, 8] и на 29% сокращенный риск смерти от ишемии сердца для людей этой группы [8].
Эксперименты также говорят о том, что соблюдение сбалансированной растительной диеты приводит к снижению давления, уровня холестерина в крови и риска возникновения атеросклероза [8-10]. Так, отказ от животной пищи может сократить прием лекарств при сердечнососудистых нарушениях. В одном из исследований группе пациентов с атеросклерозом был предложен полный переход на растительную пищу. Через год уже у 82% группы наблюдались улучшения [11]. Повторение эксперимента приводило к сходным результатам [12].
Но, быть может, преимущества соблюдения растительной диеты связаны вовсе не с отсутствием синтеза ТМАО, а с низким содержанием насыщенных жиров и холестерина в рационе? Ведь широко бытует мнение о том, что именно потребление большого количества насыщенных жиров и холестерина является главным фактором риска развития атеросклероза. Однако исследования 2013 года не подтвердили данной связи [1]. Примечательно также, что развитие атеросклеротических поражений у мышей происходило в отсутствие изменений в составе и содержании липидов, липопротеинов, глюкозы и уровня инсулина. Более того, у таких мышей не удалось выявить и признаков ожирения.
Так что возможно, кишечные бактерии, участвующие в синтезе ТМАО, - главные виновники развития атеросклероза. Если это так, то использование антибиотиков - новый возможный способ борьбы с сердечнососудистыми заболеваниями, а также их предотвращения. Как для человека, так и для мышей уже определены роды бактерий, предположительно участвующих в синтезе ТМАО. И хотя полученных данных пока недостаточно для выявления общего таксона, ответственного за синтез ТМАО, дальнейшие исследования вскоре прояснят ситуацию.
Насколько опасен атеросклероз и какова же роль ТМАО в его развитии?
Сердечнососудистые заболевания ежегодно уносят самое больше число человеческих жизней среди всех болезней. По оценкам Всемирной организации здравоохранения (ВОЗ), в 2008 году от сердечнососудистых заболеваний умерло порядка 17,3 миллионов человек; это 30% от общего количества умерших в мире [13]. Из них 7,3 миллиона приходится на смерть от ишемической болезни сердца и ее острого проявления - инфарктов; 6,2 миллиона - на смерть от инсульта [14]. И те, и другие развиваются, главным образом, из-за препятствующей току крови закупорки сосудов, возникающей при атеросклерозе.
Большинство исследователей склоняется к тому, что развитие атеросклероза представляет собой воспалительный процесс в сосудистой стенке, ключевую роль в котором играют макрофаги [15]. В развитии атеросклероза участвуют в основном жиры, входящие в составлипопротеинов низкой и очень низкой плотности (ЛПНП и ЛПОНП) [16, 17]. В случае проникновения в стенки артерий ЛПНП и ЛПОНП окисляются, привлекая макрофаги, которые в норме поглощают окисленные жиры и передают их на липопротеины высокой плотности (ЛПВП), способствуя их утилизации.
Однако возможна гиперактивация фагоцитоза окисленных жиров макрофагами: образуются так называемые пенистые клетки , продолжающие накапливать окисленные жиры во внутриклеточном пространстве, не передавая на ЛПВП. В конце концов, такие макрофаги гибнут и разрываются; активируется агрегация тромбоцитов, что приводит к увеличению свертываемости крови. При этом поглощенные ранее жиры изливаются наружу, что способствует активации все новых и новых макрофагов. Образуются фиброзные бляшки, в которых накапливаются омертвевшие ткани; в дальнейшем эти бляшки кальцифицируются. Это приводит к деформации сосудов и сужению просвета вплоть до полной закупорки.
Одним из факторов, способствующих возникновению воспаления, является ингибиторное действие ТМАО на обратный транспорт холестерина и стимуляция экспрессии рецепторов SRA и CD36 на их внешней мембране, что и ведет к нарушению поглощения модифицированных липопротеинов [3, 18, 19]. Другой фактор, вызываемый ТМАО - ингибирование накопления желчи в печени и снижение экспрессии белков, ответственных за синтез и транспорт желчных кислот. Как первый, так и второй факторы связаны с развитием атеросклероза (рис. 7), однако детали механизмов действия ТМАО на обратный транспорт холестерина, синтез и транспорт жирных кислот остаются неизвестны.
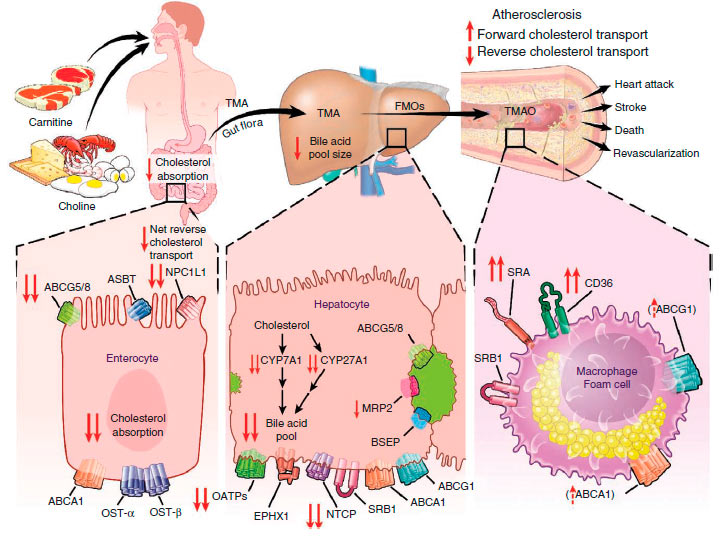
Рисунок 7. Общая схема предполагаемого метаболического пути, посредством которого микробиота влияет на развитие атеросклероза [1]. Кишечные бактерии усваивают L-карнитин и холин, формируя ТМА, а затем ТМАО. ТМАО воздействует на метаболизм холестерина и стерина в макрофагах, печени и кишечнике. Он подавляет обратный транспорт холестерина, увеличивает экспрессию рецепторов SRA и CD36 макрофагов, способствуя образованию пенистых клеток. Заключение
Вероятно, метаболический путь L-карнитина с участием кишечной микробиоты - главная причина давно замеченной взаимосвязи между обильным потреблением красного мяса и возникновением атеросклероза. Антибиотики, ингибирующие синтез ТМА кишечной флорой, могут стать новым оружием для борьбы и предотвращения сердечнососудистых заболеваний. К тому же открытие синтеза ТМАО из L-карнитина ставит под сомнение убежденность общества в абсолютной безвредности L-карнитина для здоровья и показывает необходимость его дальнейшего исследования.
Литература
- Koeth R.A., Wang Z., Levison B.S., Buffa J.A., Org E., Sheehy B.T., et al. (2013). Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med . 19, 576-585;
- Gulewitsch W., Krimberg R. (1905). Zur Kenntnis der Extrakivstoffe der Muskein, II Mitteilung. Uber das Carnitin. Hoppe-Seyler’s Z. Physiol. Chem. 45, 326-330;
- Wang Z, et al. (2011). Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature 472, 57-63;
- Rebouche C.J., Mack D.L., Edmonson P.F. (1984). l-Carnitine dissimilation in the gastrointestinal tract of the rat. Biochemistry 23, 6422-6426;
- Tang W.H.W., et al. (2013). Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk. N. Engl. J. Med. 368, 1575-1584;
- Ley R.E., et al. (2008). Evolution of mammals and their gut microbes. Science 320, 1647-1651;
- Huang T., Yang B., Zheng J., Li G., Wahlqvist M.L., Li D. (2012). Cardiovascular disease mortality and cancer incidence in vegetarians: a meta-analysis and systematic review. Ann. Nutr. Metab. 60, 233-240;
- Report of the Dietary Guidelines Advisory Committee on the dietary guidelines for Americans, 2010: to the Secretary of Agriculture and the Secretary of Health and Human Services. Washington, DC: Agriculture Research Service, US Department of Agriculture, US Department of Health and Human Services, 2010, May;
- Tuso P.J., Ismail M.H., Ha B.P., Bartolotto C. (2013). Nutritional update for physicians: plant-based diets. Perm J. 17, 61-66;
- Takahashi Y., Sasaki S., Okubo S., Hayashi M., Tsugane S. (2006). Blood pressure change in a free-living population-based dietary modification study in Japan. J. Hypertens. 24, 451-458;
- Ornish D. Brown S.E., Scherwitz L.W. et al. (1990). Can lifestyle changes reverse coronary heart disease? The Lifestyle Heart Trial. Lancet 336, 129-133;
- de Lorgeril M., Salen P., Martin J.L., Monjaud I., Delaye J., Mamelle N. (1999). Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation 99, 779-785;
- Мировой отчет по неинфекционным заболеваниям, 2010, Женева, ВОЗ;
- Global atlas on cardiovascular disease prevention and control. Geneva: World Health Organization, 2011;
- Ross R. (1993). The pathogenesis of atherosclerosis: a perspective for the 1990s. Nature 362, 801-809;
- биомолекула: «Холестериновая страшилка, которая правит миром»;
- биомолекула: «Хороший, плохой, злой холестерин»;
- Febbraio M., et al. (2000). Targeted disruption of the class B scavenger receptor CD36 protects against atherosclerotic lesion development in mice. J. Clin. Invest. 105, 1049-1056;
- Suzuki H, et al. (1997). A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection. Nature 386, 292-296.
|

