Мелатонин: роль в организме, применение в клинике
 Анисимов Владимир Николаевич - руководитель отдела канцерогенеза и онкогеронтологии НИИ онкологии им. проф. Н.Н.Петрова Росздрава, профессор, доктор медицинских наук, президент Геронтологического общества Российской академии наук, член Совета Международной ассоциации геронтологии и гериатрии, эксперт Программы ООН по старению, главный редактор журнала "Успехи геронтологии", автор более 400 научных работ, в том числе 19 монографий, 6 изобретений и патентов.
Анисимов Владимир Николаевич - руководитель отдела канцерогенеза и онкогеронтологии НИИ онкологии им. проф. Н.Н.Петрова Росздрава, профессор, доктор медицинских наук, президент Геронтологического общества Российской академии наук, член Совета Международной ассоциации геронтологии и гериатрии, эксперт Программы ООН по старению, главный редактор журнала "Успехи геронтологии", автор более 400 научных работ, в том числе 19 монографий, 6 изобретений и патентов.
Основные научные интересы связаны с изучением взаимоотношений процессов старения и возникновения злокачественных новообразований, с экспериментальной разработкой новых подходов к профилактике рака и преждевременного старения.
ВВЕДЕНИЕ
Явлением, наиболее существенным для живой природы на Земле, является смена дня и ночи, света и темноты. Вращение нашей планеты вокруг своей оси и одновременно вокруг Солнца отмеряет сутки, сезоны и годы нашей жизни. Все больше сведений накапливается о роли эпифиза (шишковидной железы) и его гормона мелатонина в регуляции биологических ритмов.
История открытия мелатонина - гормона эпифиза, регулирующего биоритмы живых организмов, достаточно драматична. А. Лернер, дерматолог из Йельского университета, занимавшийся изучением природы витилиго (заболевание кожи, характеризующееся развитием депигментированных пятен белого цвета вследствие потери пигмента меланина), задался целью выявить факторы (химические субстанции), отвечающие за формирование пигментации кожи и разрушение пигментов. Ему принадлежит честь открытия меланоцитостимулирующего гормона. В ходе литературного поиска Лернер обнаружил статью, датированную 1917 годом, в которой сообщалось о том, что измельченные эпифизы коров, помещенные в банку с головастиками, в течение 30 минут вызывают обесцвечивание их кожи, которая просто становилась прозрачной, и можно было наблюдать за работой сердца и кишечника. Других публикаций на эту тему с тех пор не было.
В 1953 году Лернеру удалось выделить из бычьих эпифизов экстракт, осветляющий кожу лягушки. С этого времени вся работа была направлена на поиски ключевого компонента. Неутомимым исследователем и его коллегами была проделана поистине титаническая работа: они переработали 250 тысяч эпифизов, однако выделенной активной субстанции было катастрофически мало. Лернер понимал, что имеет дело со сверхактивным гормоном, ведь его способность обесцвечивать кожу превышала такую способность адреналина в тысячи раз! Тем не менее, было принято решение закрыть затянувшийся эксперимент. Однако за 4 недели, отведенных на завершение работ, все же удалось идентифицировать структуру основного действующего вещества. Им оказался N-ацетил-5-метокситриптамин, которому первооткрыватель дал более романтичное имя "мелатонин" (от греческих слов melas - черный и tosos - труд). Свое открытие Лернер представил на суд общественности в одностраничной статье, опубликованной в 1958 году в Jornal of American Chemical Society. Проблему витилиго Аарон Лернер так и не решил...
Эпифиз.
Биосинтез и биологическая роль мелатонина
Эпифиз является нейроэндокринным органом и обнаружен у всех позвоночных. Его основная функция - передача информации о световом режиме в окружающей среде во внутреннюю среду организма. За счет этого обеспечивается поддержание физиологических ритмов и их адаптация к условиям внешней среды. У рыб, земноводных, рептилий и птиц свет проходит через тонкий череп, а эпифиз обладает свойством непосредственной фоторецепции (т.е. возможностью восприятия световых сигналов). Возможно, поэтому его и называют "третьим глазом".
У млекопитающих шишковидная железа является исключительно эндокринным органом, а сигналы об уровне освещенности она воспринимает через ряд посреднических структур. У человека эпифиз располагается в задней части III желудочка мозга. Его вес у взрослых мужчин достигает 125 мг, у женщин - 110 мг. Основные клеточные элементы - пинеалоциты - содержат комплексы различного размера пузырьков, которые представляют собой депо мелатонина и биогенных аминов.
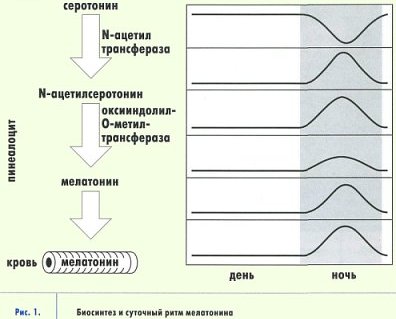
Физиологический контроль эндокринной функции эпифиза осуществляется в значительной мере световым режимом. Световая информация, воспринимаемая глазами, передается в эпифиз по нейронам супрахиазматического ядра (СХЯ) гипоталамуса через ствол верхней грудной части спинного мозга и симпатические нейроны верхнего шейного ганглия. В темное время суток сигналы от СХЯ вызывают увеличение синтеза и высвобождения норадреналина из симпатических окончаний. Этот нейромедиатор возбуждает рецепторы, расположенные на мембране пинеалоцитов, стимулируя, таким образом, синтез мелатонина. Свет угнетает продукцию и секрецию мелатонина, и поэтому его максимальный уровень в эпифизе и крови человека и животных наблюдается в ночные часы, а минимальный - в утренние и дневные (рис. 1).
Необходимо отметить, что в организме присутствует и экстрапинеальный мелатонин, то есть синтезированный вне эпифиза. Честь открытия экстрапинеальной продукции мелатонина принадлежит российским ученым Н.Т. Райхлину и И.М. Кветному. В 1974 г. они установили, что способностью синтезировать мелатонин обладают клетки червеобразного отростка кишечника. Затем было показано, что мелатонин образуется и в других отделах желудочно-кишечного тракта, а также во многих других органах и клетках - печени, почках, надпочечниках, желчном пузыре, яичниках, эндометрии, плаценте, тимусе, лейкоцитах, тромбоцитах и в эндотелии.
Феномен синтеза гормонов негормональными клетками служит подтверждением гипотезы эволюционной древности гормонов, которые, по-видимому, появились еще до обособления эндокринных желез. Вопрос о том, является ли этот путь синтеза гормона фотонезависимым, до сих пор окончательно не решен. Биологическое действие экстрапинеального мелатонина реализуется непосредственно там, где он синтезируется.
Если эпифиз уподобить биологическим часам организма, то мелатонин можно уподобить маятнику, который обеспечивает ход этих часов. Снижение амплитуды его колебаний приводит к их остановке. Пожалуй, более точно будет сравнить эпифиз с солнечными часами, в которых мелатонин играет роль тени от гномона - стержня, отбрасывающего тень от солнца. Днем солнце высоко и тень коротка (уровень мелатонина минимален), в середине ночи - пик синтеза мелатонина эпифизом и секреции его в кровь. При этом важно то, что мелатонин имеет суточный ритм, то есть единицей его измерения является хронологический метроном - суточное вращение Земли вокруг своей оси (рис. 2).
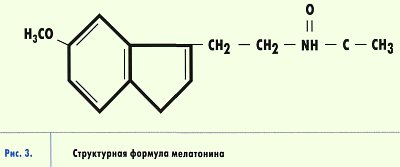
Мелатонин является производным биогенного амина - серотонина, который в свою очередь синтезируется из аминокислоты триптофана, поступающей с пищей (рис. 3). Активность ферментов, участвующих в превращении серотонина в мелатонин, подавляется освещением - вот почему производство этого гормона происходит в темное время суток. В среднем, в организме взрослого человека синтезируется за день около 30 мг мелатонина. Взаимодействие мелатонина с клетками может происходить различными путями. Мелатонин обладает амфифильными свойствами, то есть растворяется как в воде, так и в жирах. Благодаря этому он преодолевает все тканевые барьеры, свободно проходит через клеточные мембраны. Мелатонин может воздействовать на внутриклеточные процессы, как минуя систему рецепторов и сигнальных молекул, так и путем взаимодействия с ядерными и мембранными рецепторами. Рецепторы к мелатонину обнаружены в различных ядрах гипоталамуса, сетчатке глаза и других тканях нейрогенной и иной природы.
Классическим подходом к изучению физиологической функции любого эндокринного органа является удаление железы и назначение заместительной терапии ее активными субстанциями. Удаление эпифиза приводит к практически полному исчезновению мелатонина из кровеносного русла. У лабораторных животных (крыс) ускоряется половое созревание, продлевается овуляторная фаза цикла, наблюдается снижение уровня инсулина и толерантности к глюкозе, повышение уровня холестерина и свободных жирных кислот. У молодых животных ускоряется рост тела.
У собак с удаленным эпифизом повышается секреция желудочного сока, животные становятся более агрессивными.
У человека следствием эпифизэктомии (предпринятой в связи с развитием опухоли) является нарушение различных циркадианных ритмов, например, водно-солевого обмена, повышение артериального давления и другие изменения.
Таблица 1. Факторы, влияющие на уровень мелатонина
(R.J. Reiter, J. Robinson, 1995)
|
уровень мелатонина | |
|
снижают |
повышают |
|
ночной свет, высокие дозы витамина В12, кофеин (кофе, чай, напитки типа кока-колы), курение, некоторые лекарства: парацетамол, резерпин, прозак (антидепрессант), дексаметазон, нестероидные противовоспалительные средства (в т.ч. аспирин), β-адреноблокаторы (атенолол), блокаторы кальциевых каналов (нифидепин), алкоголь, выпитый около 19 часов |
темнота ночью, триптофан, никотиновая кислота (витамин В3) и пиридоксин (витамин В6), кальций и магний, некоторые антидепрессанты (ингибиторы МАО), легкая закуска на ночь, медитация, рацион с пониженной калорийностью |
Таблице 2. Основные функции эпифиза в организме
|
Регуляция циркадианных и сезонных ритмов организма |
|
Регуляция репродуктивной функции |
|
Антиоксидантная защита организма |
|
Противоопухолевая защита |
|
"Солнечные часы старения" |
Рассмотрим подробнее биологические функции мелатoнина.
Световой режим, мелатонин и регуляция суточных биоритмов
Все биологические ритмы находятся в строгой подчиненности основному водителю ритмов, расположенному в супрахиазматических ядрах гипоталамуса. Гормоном-посредником, доносящим руководящие сигналы до органов и тканей, собственно и является мелатонин. При этом характер ответа регулируется не только уровнем гормона в крови, но и продолжительностью его ночной секреции. Кроме этого, мелатонин обеспечивает адаптацию эндогенных биоритмов к постоянно меняющимся условиям внешней среды.
Регулирующая роль мелатонина универсальна для всех живых организмов, о чем свидетельствует присутствие этого гормона и четкая ритмичность его продукции у всех известных животных, начиная с одноклеточных.
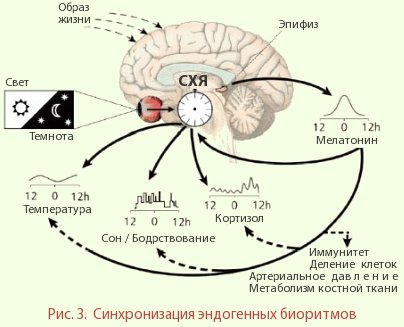
А как обстоят дела у людей? В рамках суточного ритма организма мелатонин поддерживает цикл сна/бодрствования, суточные изменения двигательной активности и температуры тела (рис. 3). Концентрация его в крови нарастает с наступлением темноты и достигает своего максимума за 1-2 часа до пробуждения. В это время сон человека наиболее глубокий, а температура тела достигает своего минимума.
Изобретение более ста лет назад электричества и искусственного освещения кардинально изменило как световой режим, так и продолжительность воздействия света на человека. Воздействие света в ночное время, часто называемое световым загрязнением, увеличилось и стало существенной частью современного образа жизни, что сопровождается множеством серьезных расстройств поведения и состояния здоровья, включая сердечно-сосудистые заболевания и рак. Согласно гипотезе "циркадианной деструкции", воздействие света в ночные часы нарушает эндогенный суточный ритм, подавляет ночную секрецию мелатонина, что приводит к снижению его концентрации в крови.
Тщательно проведенные исследования показали, что освещенность в 1,3 лк монохромного синего света или в 100 лк белого света может значительно подавить продукцию мелатонина эпифизом. Значительное снижение уровня мелатонина было обнаружено у добровольцев, подвергнутых в течение 2-х недель прерывистому воздействию света ночью. Подчеркивается, что воздействие света ночью влияет и на другие физиологические механизмы.
Циркадианная система включает в себя три ключевых компонента:
- эндогенные "часы", генерирующие циркадианный ритм;
- афферентный путь, определяющий циркадианный ритм в соответствии с астрофизическим днем;
- эфферентный путь, распределяющий сигналы от центрального генератора по периферическим органам.
В 2002 г. была обнаружена до этого еще неизвестная функция клеток нервного узла сетчатки глаза. У млекопитающих эти клетки играют ключевую роль в регуляции реакций, не связанных с визуальным световым ответом, таких как реакция поведения на свет, синтез эпифизарного мелатонина и латентный период засыпания. Показано, что аксоны нейронов ганглия сетчатки глаза соединяются сциркадианным генератором - супрахиазматическими ядрами (СХЯ) гипоталамуса. Информация о свете от сетчатки глаза передается к СХЯ через ретиногипоталамический путь, являющийся частью зрительного тракта, который заканчивается в середине СХЯ.
Молекулярный часовой механизм в СХЯ составлен из взаимодействующих положительной и отрицательной обратных связей регулирующих петель нескольких (по крайней мере, их девять) основных циркадианных "часовых" генов (Per1, Per2, PerЗ, Cry-1, Cry-2, Clock, Bmal1/Мор3, Tim и др.). Показано, что свет напрямую воздействует на экспрессию некоторых "часовых" генов, обеспечивающих циркадианный ритм. Эти гены регулируют функции клеток, контролирующих экспрессию генов ключевого клеточного цикла деления и генов апоптоза. Мутации в некоторых часовых генах драматически сказываются на многих функциях организма и приводят к развитию различных патологических процессов (таблица. 3).
Таблица 3. Мутации в часовых генах: основные эффекты
|
Per2-/- |
уменьшение продолжительности жизни, преждевременные нарушения репродуктивной функции, увеличение частоты опухолей; |
|
Clock/Clock: |
ожирение, метаболический синдром, преждевременные нарушения репродуктивной функции; |
|
Bmal1- / - |
уменьшение продолжительности жизни, увеличение ПОЛ, катаракта, саркопения; |
|
Cry1- / -Cry2- / - |
не влияет на продолжительность жизни и развитие опухолей; |
Воздействие света на функции эпифиза у человека имеет несколько особенностей, которые оказывают влияние на состояние здоровья:
- воздействие яркого света ночью (~ 2500 лк) полностью подавляет продукцию мелатонина;
- некоторые люди более чувствительны к действию освещения ночью (~200 лк), чем другие;
- сине-зеленый свет ночью угнетает продукцию мелатонина в максимальной степени;
- вероятно, действие света ночью зависит от его интенсивности;
- качество света в течение дня также, вероятно, влияет на ночное производство мелатонина;
- женщины являются более чувствительными к подавляющим эффектам ночного света на продукцию мелатонина, чем мужчины.
Свет ночью и репродуктивная функция
Искусственное увеличение продолжительности светового периода в течение дня (на 2-4 часа) приводит у грызунов к увеличению продолжительности эстрального цикла и в некоторых случаях к его нарушению. Если воздействие света увеличить до 24 ч. в сутки, у большинства мышей и крыс в короткие сроки развивается синдром персистирующего эструса. В физиологических условиях этот синдром развивается в более позднем возрасте (у крыс - обычно между 15 и 18 мес. жизни) и затем переходит в анэструс, который является физиологическим эквивалентом климактерического синдрома у женщин. В яичниках у крыс с персистирующим эструсом обнаруживают фолликулярные кисты и гиперплазию тека-ткани яичника, в них отсутствуют желтые тела. Вместо циклической продукции гонадотропинов, пролактина, эстрогенов и прогестерона, характеризующей нормальный репродуктивный период, эти гормоны секретируются ациклически, что приводит к гиперпластическим процессам в молочных железах и матке.
Имеются данные, что воздействие света ночью укорачивает продолжительность менструального цикла у женщин с длинным (более 33 дней) циклом. 60% медицинских сестер с регулярным менструальным циклом и частой работой в ночную смену имели менструальный цикл короче 25 дней. Около 70% обследованных медицинских сестер жаловались на редкие или частые дисменореи.
У крыс с персистирующим эструсом обнаруживается снижение толерантности к глюкозе и чувствительности к инсулину. Установлено, что постоянное освещение приводит к увеличению порога чувствительности гипоталамуса к ингибирующему действию эстрогенов у самок крыс. Этот механизм является ключевым в старении репродуктивной системы, как у самок крыс, так и у женщин. Итак, влияние света ночью приводит к ановуляции и ускорению, связанного с возрастом, выключения репродуктивной функции у грызунов и к дисменорее у женщин. Воздействие постоянного света увеличивает перекисное окисление липидов (ПОЛ) в тканях животных и уменьшает общую антиокислительную и супероксиддисмутазную активности, тогда как применение мелатонина вызывает снижение активности ПОЛ, особенно в головном мозге.
Мелатонин и сезонные ритмы у животных и человека
Мелатонин принимает активное участие в сезонных перестройках жизнедеятельности организмов животных. Зимняя спячка, брачные игры, сезонные перелеты, миграции и линька - все это происходит с участием эпифиза. По-видимому, мелатонин регулирует наступление сезона размножения для того, чтобы потомство рождалось в благоприятное время, когда природные условия способствуют его выживанию. Этот гормон часто используется учеными для искусственного смещения периода половой активности у лабораторных животных.
Зимняя спячка - еще один важный биологический феномен, обеспечивающий выживание в неблагоприятных условиях. В это время все системы жизнедеятельности работают в замедленном "энергосберегающем" режиме: падает температура тела, урежается ритм сердечных сокращений и дыхания. Мелатонин регулирует интенсивность расходования, запасенной в виде бурого жира, энергии. Активное "сжигание" жира начинается как раз перед весенним пробуждением.
Фотопериодичные животные с помощью оценки отклонения внутреннего циркадианного (суточного) ритма от внешнего изменения освещенности могут определять, насколько меняется долгота местности при их перемещении. Возможно, это один из механизмов навигации при птичьих перелетах.
Люди, создав себе особую среду обитания, в некоторой степени освободились от жесткого диктата внешней среды. Однако древние биологические механизмы диктуют свои законы. Продукция мелатонина у человека также имеет сезонозависимый характер и, при нарушении сезонной ритмичности, повышается риск обострения многих хронических заболеваний. Примером этого могут служить учащение депрессий и алкоголизма при перемещении на работу из средних широт в регионы крайнего Севера. У многих пациентов со злокачественными новообразованиями вообще отсутствуют сезонные ритмы биосинтеза мелатонина.
Исследования, посвященные сезонным изменениям рождаемости детей в странах северного полушария, показали, что имеется два выраженных пика - в конце декабря-начале января и в середине зимы. А это значит, что зачаты дети были именно весной, когда дневная температура поднимается до 5-7° С и солнце светит все дольше. В это время мы начинаем жить по законам природы, а не цивилизации, прибегая все меньше и меньше к искусственному свету. Именно в это время у людей повышается фертильность и любовный пыл. Зимой у женщин продукция мелатонина возрастает, а летом, при удлинении светового дня, несколько падает, что и приводит к повышению фертильности.
Антиоксидантная активность мелатонина
Антиоксидантный эффект мелатонина был открыт американским ученым Расселом Рейтером в 1993 г. и подтвержден в многочисленных исследованиях, выполненных в разных лабораториях. Основная направленность антиоксидантного действия мелатонина - защита ядерной ДНК, протеинов и липидов. Защитное действие этого гормона может проявляться в любой клетке живого организма и в отношении всех клеточных структур.
Механизм антиоксидантного действия мелатонина связан с его выраженной способностью нейтрализовать свободные радикалы, в том числе образующиеся при перекисном окислении липидов, а также с активизацией в его присутствии глутатионпероксидазы - мощного эндогенного фактора ферментативной защиты от радикального окисления. Рядом экспериментальных исследований доказано, что мелатонин обладает значительно большей активностью в отношении нейтрализации агрессивного гидроксил-радикала по сравнению с такими антиоксидантами, как глутатион и маннитол. При нейтрализации пероксильных радикалов мелатонин оказывается в 2 раза активнее витамина Е.
Невозможно переоценить роль мелатонина в реализации противоопухолевого иммунитета. В течение последних 20 лет удалось установить роль мелатонина в регуляции иммунной защиты. К настоящему времени доказано:
- рецепторы к мелатонину присутствуют на мембранах многих иммуннoкомпетентных клеток
- экзогенный мелатонин стимулирует продукцию интерлейкинов и гамма-интерферона лимфоцитами
- удаление эпифиза или введение препаратов, подавляющих синтез мелатонина, сопровождается угнетением продукции антител и пролиферации в костном мозге клеток - предшественников гранулоцитов и макрофагов
Согласно данным Международного агентства по изучению рака, в 2000 г. рак молочной железы составил большую часть заболеваний в развитых странах. Наиболее распространенным злокачественным новообразованием среди женщин - раком молочной железы (РМЖ), заболевает ежегодно 999000 женщин (22% от всех злокачественных новообразований у женщин), в результате чего умирает 375000 человек. Более половины, всех новых случаев зарегистрировано в экономически развитых странах: около 335000 в Европе и 195000 в Северной Америке. Возрастающий риск развития РМЖ обусловлен высоким социально-экономическим статусом (годовой доход, образование, жилье и т.д.), поскольку он связан с такими показателями здоровья, как начало менструальной функции и менопаузы, ожирение, высокий рост, потребление алкоголя, поздний возраст первых родов, малое количество родов, гормонозаместительная терапия, особенности питания и т.д. Следует отметить еще два фактора, харатерных для развитых стран, которые могут иметь важное значение - увеличивающееся воздействие освещением ночью и низкочастотные электромагнитные поля (50-60 Гц).
В настоящее время в некоторых отраслях промышленности число работающих посменно людей довольно значительно. Общее количество рабочих, имеющих ночную работу или работу по сменам, достигает 20% в США и 15-20% от общего количества работающих в большинстве стран Европейского Экономического Сообщества. Очевидные проблемы со здоровьем среди сменных рабочих включают нарушения сна, желудочно-кишечные заболевания, увеличение случаев сердечно-сосудистых заболеваний, нарушение метаболизма и толерантности к липидам и, возможно, увеличение случаев развития диабета.
Показано, что ожирение, высокий уровень триглицеридов и холестерина, низкая концентрация липопротеинов высокой плотности (ЛВП) обнаруживаются в этой группе чаще, чем у рабочих дневных смен. С другой стороны, имеются доказательства, показывающие, что метаболический синдром, который представлен ожирением, высоким уровнем триглицеридов и холестерина, липопротеинов низкой плотности, гипертонией, сниженной фибринолитической активностью крови, сниженной толерантностью к глюкозе, является не только фактором риска сердечно-сосудистых заболеваний, но и фактором риска возникновения злокачественных опухолей. Сообщают о гораздо большем количестве смертей от злокачественных новообразований у сменных рабочих, которые работали на производстве не менее 10 лет, по сравнению с рабочими, занятыми только в дневные смены.
В Дании в большом контролируемом рандомизированном исследовании (около 7000 обследуемых в каждой группе) было показано, что занятие вечерней работой достоверно увеличивает риск развития рака молочной железы (РМЖ) у женщин в возрасте от 30 до 54 лет. Среди работающих ночью наиболее достоверные результаты были обнаружены у официантов ресторанов, работающих в ночные смены (300 случаев). Подобные наблюдения были сделаны при обследовании стюардесс в большом когортном исследовании риска РМЖ в Финляндии. У калифорнийских стюардесс РМЖ встречался на 30 % чаще и злокачественная меланома обнаруживалась в 2 раза чаще, по сравнению с другим населением Калифорнии. С другой стороны, в недавнем контролируемом исследовании не было получено никаких убедительных доказательств, что риск РМЖ среди финских стюардесс выше, чем у других женщин.
Интересные результаты были получены в проведенном С.Дэвисом в 2001 г. в США эпидемиологическом рандомизированном исследовании. У 813 больных раком молочной железы женщин изучали особенности образа жизни за последние 10 лет по сравнению со здоровыми женщинами. При этом, учитывали экспозицию к свету в ночное время, основываясь на следующих показателях: ночная бессонница, уровень освещения в спальне ночью и работа в ночные смены (не менее 3-х ночей в месяц). Оказалось, что риск рака возрастает с учащением ночной бессонницы, увеличением уровня ночного освещения и при работе в ночную смену. В последнем случае риск также возрастал с увеличением стажа работы (таблица 4).
|
Таблица 4. Увеличение риска рака молочной железы у женщин в зависимости от экспозиции к свету в ночное время (В скобках - 95% доверительные интервалы) | |
|
Особенности образа жизни пациентов |
Риск рака молочной железы |
|
Бессонница по ночам (1 раз в неделю) |
1,14 (1,01-1,28) |
|
Бессонница по ночам (2 раза в неделю) |
1,4 (1,0-2,0) |
|
Бессонница по ночам (более 4-х раз в неделю) |
2,3 (1,2-4,2) |
|
Яркое освещение в спальне |
1,4 (0,8-2,6) |
|
Работа в ночную смену |
1,6 (1,0-2,5) |
По данным Евы Шернхаммер с соавт. (2001 г.), основанных на исследовании состояния здоровья медицинских сестер, включавшем в себя вопросы о стаже, сменной работе, дневных, ночных и вечерних сменах, среди медсестер, имеющих стаж более 30 лет и сменную работу, относительный риск РМЖ составлял 1,36 по сравнению с медицинскими сестрами, которые не работали посменно. У медсестер, длительно работающих в ночные смены, был найден сниженный уровень мелатонина и повышенный уровень эстрогенов в крови. Проведенный метаанализ, основанный на 13 исследованиях, включающих семь исследований работников авиалиний и шесть исследований представителей других профессий, работающих в ночные смены, показал, что общая оценка риска равнялась 1,48. Существенный риск развития РМЖ имели летный состав авиалиний и женщины, работающие в ночные смены.
В исследовании, объектом которого были данные о здоровье почти 45 тысяч медицинских сестер в Норвегии, было установлено, что показатель дополнительного риска РМЖ у работавших по ночам в течение 30 и более лет составил 2,21. Увеличенный риск РМЖ и рака толстой кишки был обнаружен у длительно работавших по ночам жителей Сиэттла.
Были получены данные об увеличенном риске рака толстой кишки и рака прямой кишки у женщин, работающих на радио и телеграфе. В 2003 г. Е. Шернхаммер и ее коллеги, рассмотрев Гарвардские данные по изучению состояния здоровья 79 тысяч медсестер, обнаружили, что медсестры, работающие в ночные смены, имеют более высокий риск РМЖ. Авторы также нашли, что рак толстой и прямой кишки встречаются чаще у рабочих, имеющих не менее 3 ночных смен в месяц в течение 15 и более лет. Повышенный риск злокачественных лимфом был обнаружен среди исландских стюардесс. Сообщают об увеличении риска возникновения рака простаты у скандинавских пилотов авиалиний в зависимости от количества продолжительных рейсов.
Механизмы, лежащие в основе увеличенного риска рака среди ночных рабочих и летных экипажей, возможно, схожи. Вероятно, нарушение циркадианных ритмов и вынужденное воздействие света в ночное время приводят к уменьшению выработки мелатонина, являющегося известным биологическим блокатором развития злокачественных новообразований.
Действие света ночью и спонтанный канцерогенез у грызунов
Еще в 1 964 г. немецкий исследователь В. Йохле сообщил, что количество опухолей молочной железы и обусловленных ими смертей у мышей, содержавшихся в помещении с круглосуточным освещением, значительно больше, чем животных, находившихся при обычном световом режиме. Аналогичная закономерность прослеживалась и в отношении других опухолей. В 1966 году сотрудник Онкологического научного центра в Москве И.О. Смирнова обнаружила развитие гиперпластических процессов в молочной железе и мастопатий у 78-88% самок крыс через 7 месяцев после начала воздействия постоянного освещения. По данным И.А. Виноградовой из Петрозаводского государственного университета, доложенным в 2005 году на научной конференции "Световой режим, старение и рак" в г. Кондопоге, при содержании в условиях постоянного освещения до 18-месячного возраста доживает чуть больше половины самок крыс, тогда как почти 90% крыс были живы к этому сроку в комнате, в которой поддерживался стандартный режим освещения. Спонтанные опухоли были обнаружены у 30% крыс, содержавшихся при постоянном освещении, против 16% - при стандартном режиме освещения.
В опытах, проведенных в нашей лаборатории Д.А.Батуриным, воздействие постоянного освещения у самок мышей, несущих ген рака молочной железы HER-2/neu, сопровождалось увеличением множественности аденокарцином молочной железы по сравнению с группой стандартного освещения. Следует отметить, что эффект постоянного освещения был пропорционален интенсивности освещения. Воздействие постоянного освещения значительно ускоряло возрастные нарушения репродуктивной функции и существенно усиливало спонтанный канцерогенез у мышей линии СВА. Немецкий исследователь К. Бартш обнаружил, что постоянное освещение, начатое в возрасте 30 дней, приводило к ускорению развития спонтанных аденокарцином эндометрия у крыс линии BDII/Han.
Воздействие света ночью и канцерогенез, индуцированный химическими агентами
В 1965 г. И.К. Хаецкий из Киевского Института проблем онкологии впервые сообщил о стимулирующем влиянии постоянного освещения на вызванный введением 7,12-диметилбенз(а)антраценом (ДМБА) канцерогенез молочных желез у крыс. При содержании животных с момента рождения при постоянном или стандартном режимах освещения количество аденокарцином молочных желез у крыс, получивших 20 мг ДМБА внутрь в возрасте 55 дней, составило, соответственно 95% и 60%. Применение мелатонина существенно угнетало развитие индуцированных ДМБА опухолей в обеих изучаемых группах. Введение другого канцерогена, N-нитрозометилмочевины (НММ), крысам, содержащимся при стандартном режиме освещения, сопровождалось развитием аденокарцином молочных желез у 55% животных. Воздействие постоянного освещения значительно увеличивало количество развившихся аденокарцином молочных желез и уменьшало их латентный период. У крыс, находящихся в условиях постоянного освещения, отмечался ночной подъем уровня пролактина и уменьшался уровень мелатонина в сыворотке крови по сравнению с аналогичными показателями, определяемыми у крыс, содержащихся в условиях стандартного освещения (Д. Ш. Бениашвили и др., 1993). Эти данные согласуются с другими наблюдениями относительно стимулирующего эффекта постоянного освещения на канцерогенез молочных желез, индуцированный ДМБА или НММ.
Группа французских исследователей, возглавляемая Ф. Леви, в 1999 году сообщила, что нарушение циркадианных ритмов организма при помощи постоянного воздействия света оказывало стимулирующий эффект на канцерогенез в печени, индуцируемый N-нитрозодиэтиламином у крыс. А.В. Панченко (2006) наблюдал существенное увеличение количества аденокарцином в восходящем и нисходящем отделах толстой кишки при введении 1,2-диметилгидразина (ДМГ) крысам, которые находились в условиях постоянного освещения, по сравнению с количеством аналогичных опухолей у крыс, содержащихся в условиях стандартного освещения и также получивших инъекции этого канцерогена.
В наших экспериментах, выполненных совместно с Д. Ш. Бениашвили, было изучено влияние постоянного освещения на трансплацентарный канцерогенез, индуцируемый N-нитрозоэтилмочевиной (НЭМ). В этом опыте крысы содержались в комнате с круглосуточно включенным светом на протяжении всей беременности и в период вскармливания потомства, после чего потомство содержалось при обычном световом режиме. Исследование показало, что даже кратковременное воздействие постоянного освещения стимулировало развитие индуцируемых этим канцерогеном опухолей нервной системы и почек у потомства, по сравнению с потомством крыс, которые постоянно находились в комнате со стандартным режимом освещения.
Таким образом, постоянное освещение обладает активирующим влиянием на развитие индуцированных химическими канцерогенами опухолей различных локализаций.
Свет ночью и рост перевиваемых опухолей
Каким образом воздействие света ночью действует на развитие уже развившихся новообразований? Ответ на этот вопрос дают результаты опытов с перевиваемыми опухолями.
Воздействие постоянного освещения (300 лк или 0.2 лк) уменьшало ночной пик уровня мелатонина и увеличивало темп роста перевиваемой гепатомы у крыс. Если темнота в ночное время прерывалась включением белого света в 300 лк, крысы с трансплантированными клетками рака молочной железы человека (линия МСF-7) имели более низкую ночную концентрацию мелатонина в сыворотке крови и карцинома у них развивалась быстрее, чем у крыс, находящихся в условиях нормального чередования света и темноты. Постоянное освещение стимулировало рост перевиваемой карциномы Эрлиха у мышей. Чередование каждые 3 дня фотопериодов 14 ч. свет : 10 ч. темнота и, наоборот, 10 ч. темнота : 14 ч. свету мышей с привитой карциномой Эрлиха или саркомой-180 сопровождалось сокращением времени выживания, ускорением роста опухоли и депрессией иммунной системы по сравнению с аналогичными параметрами у животных, содержавшихся при постоянном фотопериоде 12 ч. свет : 12 ч. темнота или 14 ч. свет : 10 ч. темнота.
Влияние генетического или хирургического нарушения циркадианного ритма на рост опухоли
Мыши с полной мутацией гена Реr2, приводящей к нарушению циркадианного ритма, имели повышенную восприимчивость к развитию лимфом после воздействия гамма-радиации. Было также показано, что эти мыши более склонны к спонтанному развитию опухолей по сравнению с контрольными животными.
Остеосаркома Глазго или аденокарцинома поджелудочной железы РОЗ были пересажены интактным (контрольным) мышам или мышам с двусторонним электрическим разрушением СХЯ гипоталамуса. Рост опухолей был быстрее у животных с поврежденными СХЯ, чем у ложно оперированных. Разрушение СХЯ являлось главной причиной нарушения циркадианной ритмики кортикостерона и ритма деления лимфоцитов у этих мышей.
В клинических исследованиях отмечено, что сохраненный 24-часовой ритм активности связан с более длительным выживанием пациентов с метастатическим раком толстой кишки. Недавно были выявлены нарушения экспрессии трех часовых генов (Рer1, Рer2, РerЗ) в большинстве (< 95%) случаув рака молочной железы у женщин. Это может привести к нарушению контроля над нормальным циркадианым ритмом и таким образом увеличить выживание раковых клеток и усилить неопластический процесс.
В настоящее время пока не ясно, уникален ли ген Рer2 в качестве "супрессора опухоли" или имеются другие часовые гены, выполняющие подобную противоопухолевую функцию в естественных условиях. Механизм подавления роста опухоли также пока не ясен, но имеется важное наблюдение - раковые ткани определенно связаны со специальными часовыми генами. В течение 2006 года было опубликовано еще 6 работ, свидетельствующих о нарушениях в функции часовых генов у больных раком ряда других локализаций.
Данные, полученные на крысах и людях, показывают, что опухоли и имеющие опухоль особи могут иметь значительно измененные циркадианнные ритмы. Мы наблюдали существенное нарушение циркадианного ритма мелатонина в сыворотке крови, активности пинеалоцитов и содержания биогенных аминов в СХЯ гипоталамуса и преоптической области у крыс, имеющих рак толстой кишки, вызванный 1,2-диметилгидразином.
Экологические и генетические факторы, которые повреждают системный и/или местный циркадианный ритм, могут ставить под угрозу временное регулирование деления клеток и таким образом усиливать рост опухоли.
Темнота и рак
Если свет, подавляющий продукцию мелатонина эпифизом, стимулирует преждевременное старение и развитие рака, то естественен вопрос - а как действует на эти процессы темнота? Доктор А.К. Кураласов из Алма-Аты в 70-80 годах прошлого века изучал влияние темноты на рост и развитие опухолей молочных желез у крыс. Животные содержались в темном помещении (0-0,5 люкс/см2) или при стандартном световом режиме (12 ч. свет/12 ч. темнота).
|
Таблица 5. Эффекты постоянного освещения |
|
Угнетение синтеза и секреции мелатонина |
|
Увеличение синтеза и секреции пролактина |
|
Увеличение порога чувствительности гипоталамуса к торможению эстрогенами |
|
Индукция ановуляции и кист яичника |
|
Стимуляция пролиферативных процессов и рака в молочной железе и эндометрии |
|
Усиление образования активных форм кислорода |
|
Стимуляция атеросклероза и развития метаболического синдрома |
Оказалось, что рост перевиваемого рака молочной железы в темноте существенно замедлялся. Введение канцерогена ДМБА крысам, которых содержали в темноте, индуцировало гораздо меньше опухолей молочной железы, чем у содержавшихся при стандартном освещении. Продолжительность жизни крыс с опухолями молочной железы в группе, содержавшейся в темноте, была в 2 раза большей, чем у животных в контрольной группе, находившейся в условиях стандартного светового режима.
А. К. Кураласов установил также, что содержание животных в темноте усиливало противоопухолевый эффект таких препаратов, как синестрол, тамоксифен, андрогены, тио-ТЕФА, циклофосфамид, ЦМФ, тио-ТЕФА + синестрол.
Впечатляющие результаты экспериментальных исследований позволили автору использовать этот подход для терапии больных РМЖ. Под наблюдением находилось 138 пациентов (T2-4 N2-3 МО). Некоторые из них (54 случая) получали полихимиотерапию (модифицированная схема Купера + гормонотерапия). Радиотерапия проводилась 46 больным, радиотерапия с химиотерапией - 38 больным. У больных с РМЖ в пременопаузе наблюдался пониженный уровень 17-β-эстрадиола (в 7 раз) и ФСГ в сыворотке крови, тогда как уровень тестостерона и прогестерона был повышен, по сравнению с параметрами этих гормонов у этих же больных до воздействия режимом постоянной темноты. У женщин в постменопаузе эти изменения были менее выражены, чем у женщин в пременопаузе. Дексаметазоновый тест был отрицательным у 62,5% больных раком молочной железы, находившихся при стандартном световом режиме, и только у 9,5% больных, находившихся в темноте. Полная или частичная (>50%) регрессия карциномы молочной железы наблюдалась у 32,4 % больных контрольной группы и у 78,6% больных "темновой" группы. Индекс операбильности в этих группах составил 36% и 88%, соответственно.
|
Таблица 6. Возможные механизмы угнетающего воздействия мелатонина на канцерогенез молочной железы | |
|
Показатели |
Эффект |
|
Уровень гонадотропинов (ФСГ и ЛГ) |
снижается |
|
Уровень пролактина |
снижается |
|
Гормон роста, инсулино-подобный фактор роста-1 |
снижается |
|
Уровень инсулина |
снижается |
|
Уровень эстрогенов |
снижается |
|
Экспрессия эстрогеновых рецепторов |
снижается |
|
Мутагенез |
снижается |
|
Кластогенное действие |
снижается |
|
Аддукты ДНК |
снижается |
|
Пролиферативная активность |
снижается |
|
Апоптоз |
повышается |
|
Образование активных форм кислорода |
снижается |
|
Система антиоксидантной защиты |
повышается |
|
Усвоение линолевой кислоты |
снижается |
|
Иммунный надзор |
повышается |
|
Генная экспрессия иммуномодулирующих цитокинов |
повышается |
|
Экспрессия онкогенов (HER-2/neu, ras) |
снижается |
Таким образом, опыты с грызунами и наблюдения клиницистов убедительно свидетельствуют об ингибирующем действии световой депривации на канцерогенез молочной железы. Эпидемиологические данные также подтверждают такой вывод. Американский эпидемиолог Р. Хан в 1991 году сообщил о результата анализа свыше 100000 выписных эпикризов, опубликованных в Национальном госпитальном регистре. Риск развития рака молочной железы оказался в 2 раза меньшим у первично слепых женщин по сравнению со зрячими. В ряде исследований, выполненных в последние годы учеными Швеции и Финляндии, было обнаружено существенное снижение риска всех видов рака среди слепых, и этот уменьшенный риск является специфичным для рака молочной железы у женщин.
Влияние мелатонина на развитие опухолей у животных и человека
В опытах на различных моделях индуцированного химического канцерогенеза было обнаружено, что применение мелатонина оказывает угнетающее влияние на возникновение и развитие опухолей молочной железы, шейки матки и влагалища, кожи, подкожной клетчатки, легких, эндометрия, печени, толстой кишки у животных, что свидетельствует о значительной широте спектра антиканцерогенного эффекта мелатонина. Противоопухолевому действию мелатонина in vitro и in vivo также посвящено большое количество работ. Данные исследований на животных хорошо согласуются с результатами клинических наблюдений. Так, в работе канадских исследователей Э. Милса и соавт. (2005) представлены результаты мета-анализа 10 рандомизированных контролируемых исследований эффективности применения мелатонина для лечения онкологических больных с солидными формами опухолей. В общей сложности лечение получили 643 пациента. Применение мелатонина снизило относительный риск смерти в течение 1 года до 0,66, причем, не было зарегистрировано серьезных побочных эффектов препарата.
Возможные механизмы ингибирующего воздействия мелатонина на канцерогенез молочной железы интенсивно обсуждаются в последнее время. Установлено, что мелатонин оказывает эффект как на системном, так и на тканевом, клеточном и субклеточном уровнях. При этом действие мелатонина препятствует процессам, ведущим к старению и раку. В частности, на системном уровне мелатонин снижает продукцию гормонов, способствующих этим процессам и стимулирует систему иммунного надзора. Одновременно подавляется продукция свободных радикалов кислорода и стимулируется система антиоксидантной защиты. Мелатонин тормозит пролиферативную активность клеток и повышает уровень апоптоза, препятствуя возникновению и развитию опухолевого процесса. На генетическом уровне он ингибирует эффект мутагенов и кластогенов, а также подавляет экспрессию онкогенов (рис.5).
Представленные данные свидетельствуют о важной роль шишковидной железы в развитии рака. Угнетение функции эпифиза при использовании постоянного режима освещения стимулирует канцерогенез. Эпидемиологические наблюдения относительно увеличения риска РМЖ и РТК у рабочих ночных смен соответствуют результатам экспериментов на грызунах. Применение эпифизарного гормона мелатонина угнетает канцерогенез у животных, находящихся в условиях как обычного режима освещения, так и при постоянной освещении.
Таким образом, применение мелатонина с целью профилактики рака может оказаться весьма эффективным, особенно в северных регионах, где летом имеют место "белые ночи", а в течение долгой полярной ночи всюду горит электрический свет.
Суммируя все вышесказанное, можно заключить, что спектр эффектов мелатонина очень широк. В отличие от многих гормонов его действие на клеточные структуры зависит не только от его концентрации в крови и межклеточной среде, но и от исходного состояния клетки. Это позволяет считать мелатонин универсальным эндогенным адаптогеном, поддерживающим баланс организма на определенном уровне и позволяющим адаптировать все происходящие процессы к непрерывно меняющимся условиям окружающей среды и локальным воздействиям на организм.
Антистрессорные эффекты мелатонина
Эпифиз является важным элементом системы антистрессорной "обороны" организма, и мелатонину в этом отводится важная роль фактора неспецифической защиты (Э.Б. Арушанян, 2004). У высокоорганизованных животных, и тем более человека, пусковым моментом при развитии стресса служат негативные эмоции. Мелатонин способствует ослаблению эмоциональной реактивности.
К отрицательным последствиям стресса можно отнести усиление процессов свободно-радикального окисления, в том числе и перекисного окисления липидов, что приводит к повреждению клеточных мембран. Защитные возможности мелатонина в этом отношении мы уже обсуждали.
Стресс в обязательном порядке сопровождается обширными сдвигами в эндокринной сфере, которые в первую очередь затрагивают гипоталамо-гипофизарно-надпочечниковую ось. Участие мелатонина носит "поправочный" характер: гормон подключается к эндокринной регуляции только в случае резких отклонений в работе надпочечников.
Существует целая серия доказательств неблагоприятного влияния хронического стресса на иммунную систему. В частности, у лиц, длительное время переживающих психотравмирующую ситуацию, наблюдается выраженное снижение уровня Т-лимфоцитов в крови. В этой ситуации мелатонин оказывает как прямое действие на иммунокомпетентные клетки, так и опосредованное, через на гипоталамус и другие нейроэдокринные струкуры.
Эксперимент, поставленный в 1988 г. швейцарским исследователем Д. Маэстрони, показал, что мелатонин помогает преодолеть стресс даже на фоне вирусной инфекции. Инфицированных вирусом мышей помещали в стрессогенную среду. Инфекция и стресс вызывали выраженные изменения в иммунной системе. Опытной группе животных инъецировали раствор мелатонина. Через 30 дней наблюдалась следующая картина: выжили всего 6% животных из контрольной группы, 82% - из опытной. И это при том условии, что им исходно предназначалась большая стрессовая нагрузка.
Хронический стресс (например, связанный с болью или иммобилизацией) приводит к выраженному рассогласованию суточных биоритмов, при этом возникают проблемы со сном, изменяется ЭЭГ, нарушается секреция ряда биологически активных соединений. И хотя основным "водителем ритма" в организме является не эпифиз, а супрахиазматическое ядро гипоталамуса, оба этих образования взаимодействую при посредничестве мелатонина (рецепторы к нему есть в клетках СХЯ), который способен ограничивать ход "спешащих часов" основного ритмоводителя.
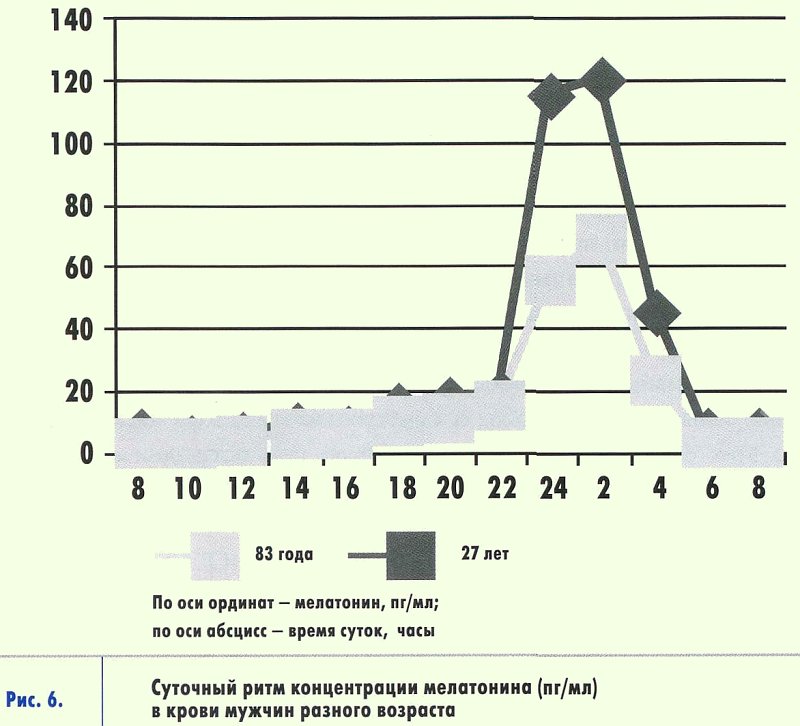
Возрастные изменения секреции мелатонина
В течение жизни наблюдается устойчивая тенденция постепенного снижения продукции мелатонина (рис. 6). Хотя у новорожденных продукция мелатонина крайне низка. Скорее всего "ориентироваться" во времени им помогает мелатонин, получаемый с молоком матери. Однако уже с 3-месячного возраста младенцы переходят на продолжительный ночной сон, а днем у них увеличиваются периоды бодрствования. Возможно, это связано с налаживающейся секрецией мелатонина. Детей, у которых суточные ритмы долго не устанавливаются, можно узнать сразу: они "путают" день и ночь, сбивая с толку измученных родителей. И среди них больше тех, кто находится на искусственном вскармливании.
У здоровых детей уровень мелатонина в крови постепенно нарастает вплоть до года и сохраняется на достаточно высоком уровне до пубертатного периода. Причем, у ребят младшего возраста ночной уровень мелатонина выше дневного примерно в 40 раз. У маленьких детей этот гормон выполняет две функции: увеличивает продолжительность сна и подавляет секрецию половых гормонов. В период полового созревания количество циркулирующего в крови гормона снижается, причем наиболее отчетливо это происходит именно в период наступления половой зрелости. Разница между ночным и дневным уровнем сокращается до 10 раз.
Отмечено, что дети с замедленным половым созреванием имеют более высокий уровень мелатонина. Если уровень гормона продолжает оставаться высоким (в 5 и более раз выше возрастной нормы), половое созревание затягивается надолго.
Что касается взрослых людей, то, возможно, именно благодаря мелатонину они видят эротические сны. Не без участия мелатонина сон переходит в "быструю стадию" (парадоксальный сон, характеризующийся активными движениями глазных яблок под сомкнутыми веками). В это время в нашей памяти оживают яркие эмоциональные переживания, в том числе и связанные с сексом.
У людей в возрастной группе 60-74 года большинство физиологических показателей претерпевают положительный фазовый сдвиг так называемого циркадианого (околосуточного) ритма примерно на 1,5-2 часа вперед. У лиц старше 75 лет нередко возникает десинхронизация секреции многих гормонов, температуры тела, сна и некоторых поведенческих ритмов.
С чем это может быть связано? Возможно, с эпифизом. При старении функция шишковидной железы угнетается, что проявляется прежде всего нарушением ритма продукции мелатонина, и снижением уровня его секреции.
Что касается размера и структуры эпифиза, то здесь сведения достаточно противоречивы. Некоторые исследователи сообщают о выраженной инволюции железы, возрастном доминировании стромальных (неактивных) клеток. Другие же говорят о том, что "истинной сенильной атрофии эпифиза не происходит", хотя в его тканях обнаруживается накопление липофусцина - важного маркера старения. У пожилых людей с болезнью Альцгеймера отмечено существенное снижение ночного уровня мелатонина по сравнению с практически здоровыми лицами того же возраста, а вот дневной уровень достоверно повышен.