В англоязычной научной литературе любое вмешательство, которое может задержать развитие возрастных изменений, принято обозначать термином «anti-aging medicine», в русскоязычной литературе это понятие включает термин «геронтология». Фармакологические субстанции, которые теоретически могут продлевать жизнь, в англоязычной литературе принято называть «anti-aging drugs», что соответствует использующемуся в русскоязычной литературе термину «геропротекторы». На сегодняшний день предполагать, что какой-либо конкретный, уже известный геропротектор будет достоверно замедлять, останавливать или поворачивать вспять процесс старения организма человека, рискованно. Сомнения в эффективности вмешательства в процесс старения усугубляются и отсутствием общепринятого определения самого старения, и отсутствием нормы для биомаркеров, которыми пытаются измерить скорость процесса. Однако поиск в данном направлении, безусловно, интересен и привлекателен с общечеловеческих позиций. Итак, геропротекторы (дословный перевод «защищающие от старости») - общее название для группы веществ, в отношении которых обнаружена способность увеличивать продолжительность жизни (ПЖ) животных.
Возможность продления жизни в эксперименте была продемонстрирована для многих геропротекторов, включая антиоксиданты, хелатные агенты, латирогены (вещества, препятствующие образованию сшивок, в частности молекул коллагена соединительной ткани), адаптогены, нейротропные препараты, ингибиторы моноаминоксидазы, глюкокортикоиды, дегидроэпиандростерон, половые гормоны, гормон роста, мелатонин, препараты эпифиза, ингибиторы биосинтеза белка, антидиабетические средства, тимические гормоны, иммуномодуляторы и энтеросорбенты, а также миметики супероксиддисмутазы и каталазы [1-3]. Многие натуральные пищевые добавки и синтетические препараты, особенно некоторые антиоксиданты, витамины и гормоны, стали в последние годы предметом активной коммерческой эксплуатации, несмотря на отсутствие серьезных научных доказательств их эффективности [4]. По мнению многих авторов, на сегодня нет ни одного химического геропротектора, позитивный эффект которого был бы неоспоримо доказан (из чего, впрочем, не следует, что их не может быть в принципе) [5].
Среди причин, не позволивших до сих пор разработать «истинные» геропротекторы, - отсутствие средств, предоставляющих возможность надежно идентифицировать их эффект в эксперименте. Исторически единственным критерием, позволяющим судить об эффективности геропротекторов, является увеличение с их помощью ПЖ экспериментальных животных. Однако увеличение ПЖ как таковое вряд ли может являться эффективным критерием истинного геропротекторного действия изучаемых субстанций. Известно, что продление жизни было неоднократно выявлено при использовании таких препаратов, относить которые к геропротекторам нет никаких оснований, - ДДТ, радиоактивная пыль и т.д. [6]. Причиной подобных эффектов принято считать гормезис - позитивное влияние малых доз определенных субстанций или воздействий, которые в больших дозах имеют негативное влияние на организм [7]. Гормезис неоднократно был продемонстрирован при добавлении в корм экспериментальным животным и в качестве подкормки растениям таких веществ, как гербициды, пестициды, инсектициды, углеводороды, этанол, растворители и т.д. [8].
В последние годы активно обсуждается возможность использования горметического эффекта в геронтологии [9,10]. Результаты многих экспериментальных и эпидемиологических исследований показали, что гормезис может являться эффективным средством противодействия разным возраст-зависимым патологиям, включая диабет, рак, кардиоваскулярные и нейродегенеративные заболевания. Показано, что в процессе гормезиса важную роль играют экстраклеточные сигнальные молекулы, такие как кислород, монооксид углерода, оксид азота, нейротрансмиттерглутамат, ион кальция и фактор некроза опухоли [11].
Клеточные и молекулярные механизмы гормезиса в последние годы являются предметом активного изучения. Показано, что важную роль в его проявлении играют активация сигнальных путей факторов роста, синтез белков теплового шока и ситруинов, индукция антиоксидантных и репаративных систем, активация мембранных рецепторов, стимуляция иммунной системы, компенсаторная клеточная пролиферация и некоторые другие механизмы [12,13]. В геронтологическом отношении наиболее важным является то, что с помощью гормезиса можно продлевать жизнь экспериментальных организмов. Увеличение ПЖ в эксперименте было обнаружено как при использовании разных «мягких» стрессов (облучения, холодового и теплового шока, гипергравитации и т. д.) [14], так и при применении химических субстанций (антибиотиков, гербицидов, пестицидов, тяжелых металлов и углеводородов) [15].
Обычно предполагается, что способность геропротекторов продлевать жизнь связана с их специфическим действием на механизмы, определяющие темп старения. Альтернативным объяснением подобных эффектов может быть индукция у организмов, перенесших стресс, горметического адаптивного ответа. В современной геронтологической литературе общепринято, что благоприятные эффекты геропротекторов объясняются их специфическим действием на определенные механизмы, детерминирующие темп старения. Например, в соответствии со свободнорадикальной теорией старения [16], свободные радикалы, образующиеся в процессе метаболизма, повреждают ДНК, белки, мембраны и другие структуры клеток, приводя к возраст-зависимому снижению функциональных возможностей организма, а антиоксиданты могут, нейтрализуя свободные радикалы, замедлять процесс старения. Однако большинство антиоксидантов многофункциональны. Например, витамин С может действовать в качестве антиоксиданта, хелатирующего агента, восстановителя (reducingagent) и поглотителя кислорода (oxygenscavenger) [17]. Таким образом, эффекты геропротекторов вряд ли могут быть следствием их действия по единственному специфическому («anti-aging») механизму.
По состоянию на начало 2011 г. выделяют более 30 веществ, обладающих такими свойствами. В частности, к геропротекторам относят:
• ресвератрол и другие полифенолы растительного происхождения;
• рапамицин;
• антиоксиданты (витамины А, Е и С, каротиноиды, липоевая кислота, кофермент Q, микроэлемент селен и др.);
• янтарную кислоту;
• ингибиторы биосинтеза белка (оливомицин, актиномицин);
• гормоны (гормон роста, гормоны щитовидной железы, гормоны коры надпочечников, половые гормоны, мелатонин);
• пептидные биорегуляторы (тималин, эпиталамин);
• бигуаниды (метформин, фенформин);
• адаптогены (препараты женьшеня и элеутерококка).
В отличие от гериатрических средств, предназначенных для лечения заболеваний у пожилых или улучшения качества жизни, геропротекторы могут применяться в молодом и зрелом возрасте. Однако вопрос о безопасности их длительного применения требует еще дополнительного изучения. Существует значительное число теорий, описывающих молекулярные механизмы старения, и столь же значительное число геропротекторов, предложенных на основании этих теорий. Но на современном этапе не найдено идеальных способов коррекции и регулировки механизмов старения. Имеющиеся в литературе данные о геропротекторах весьма фрагментарны, противоречивы и часто ненадежны, - как с точки зрения адекватности проведения такого рода исследований, так и их интерпретации.
В итоге приходится констатировать, что известно совсем немного веществ, геропротекторные свойства которых можно считать с достаточной надежностью установленными. Среди них особого внимания заслуживает метформин.
Результаты исследований на млекопитающих привели к предположению, что гипергликемия и гиперинсулинемия являются важными факторами как в процессах старения, так и в развитии рака. Кроме того, определено, что эффект удлинения жизни при ограничении калорий связан со снижением уровня IGF-1 [18]. Эти экспериментальные факты положили начало поиску геропротекторов среди антидиабетических препаратов, основанием являлось утверждение, что лекарственные препараты, которые снижают уровень инсулина и глюкозы, могут обладать потенциалом миметиков - эффектом ограничения калорийности (calorierestrictionmimetics - (CR)) [19-21]. CR-эффект реализуется в активации AMPK (adenosinemonophosphate (AMP)-activatedproteinkinase) и ингибировании mTOR/S6K1, сопровождающихся выраженной стимуляцией аутофагии.
Недавно C. Selman и соавт. показали, что потеря рибосомного белка S6 kinaseS6K1 (мишени mTOR) под действием фармакологических средств может обеспечить эффект долголетия млекопитающих [22]. Поскольку бигуаниды и, в частности, метформин, используются в лечении диабета для подавления глюконеогенеза и повышения чувствительности к инсулину, т.е. являются типичными CR-миметиками [23], именно эта группа препаратов исследуется наиболее интенсивно.
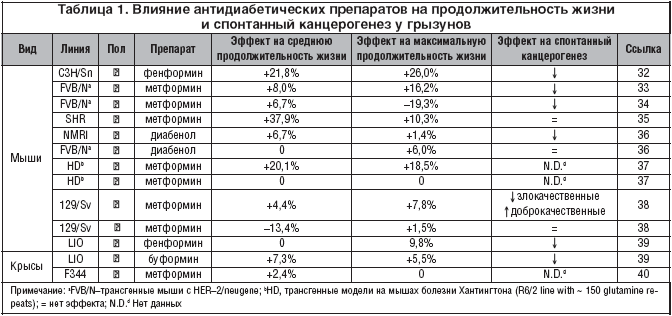
К настоящему времени установлено, что бигуаниды частично имитируют CR-транскрипционный ответ у мышей [24] и увеличивают среднюю ПЖ [25]. Кроме того, ряд исследований показал, что метформин, фенформинибуформин задерживают возникновение и тормозят развитие опухолей [26-28]. Однако относительно испытаний метформина как миметика CR на фоне нормальной диеты и у здоровых животных, а не на моделях заболеваний известно меньше. Так, описан эффект длительного применения метформина (300 мг/кг/сут.) у здоровых крыс-самцов Fischer-344 на фоне стандартной диеты. D.L.Jr. Smith, T.R. Nagy и D.B. Allison [29] установили, что метформин только незначительно увеличивал ПЖ по сравнению с контролем. Сходные результаты в отношении самцов экспериментальных животных получены и V.N. Anisimov: длительное лечение инбредных 129/Sv мышей метформином (100 мг/кг в питьевой воде) привело к снижению на 13,4% средней ПЖ самцов мышей и к некоторому увеличению средней ПЖ самок мышей (на 4,4%). Лечение метформином не влияло на спонтанную заболеваемость опухолями самцов 129/Sv мышей, но снизило в 3,5 раза заболеваемость злокачественными новообразованиями у самок мышей, и в то же время несколько стимулировало появление доброкачественных сосудистых опухолей (табл. 1) [30,31].
В клиническом исследовании установлено, что метформин уменьшает риск появления когнитивных нарушений у пожилых пациентов 76±6 лет, а розиглитазон потенцирует это действие метформина [41].
Метформин-индуцированное подавление гиперэкспрессии HER2 происходит через AMPK (5'АМФ-активируемая протеинкиназа (АМФК, англ. AMPactivatedproteinkinase, AMPK) - клеточная протеинкиназа, контролирующая энергетический баланс клетки) независимое ингибирование активности p70S6K1 киназы, которая является эффектором mTOR. К тому же инкубирование с веществами, подавляющими продукцию активных форм кислорода (АФК) (например, N-ацетилцистеином), значительно усиливает способность метформина снижать экспрессию HER2. Эти данные позволяют предполагать, что метформин можно использовать в качестве профилактического средства для HER2-положительного рака груди.
Усиление ингибирования mTOR/p70S6K1 в сочетании с подавлением продукции АФК представляет собой ранее неизвестную связь антивозрастного и антиопухолевого действия метформина. Популяционные исследования на человеке показали, что использование антидиабетического средства метформина значительно снижает риск рака молочных желез, онкоген HER2 может представлять собой мишень для метформина в отношении его противоопухолевого действия [42].
Популяционные исследования продемонстрировали, что использование антидиабетического средства метформина значительно снижает риск рака груди. Исследования на животных показали, что метформин подавляет развитие карциномы молочной железы у трансгенных мышей женского пола, влияя на онкоген HER2 (рецептор эпидермального фактора роста), что не наблюдается при спонтанных опухолях [43]. Испанские ученые из Catalan Institute of Oncology (ICO), Girona Biomedical Research Institute (IdIBGi), Dr. J. Trueta (University Hospital of Girona) выяснили, что онкоген HER2 может представлять собой мишень для метформина в отношении его противоопухолевого действия [44]. Во-первых, гиперэкспрессия HER2 значительно усиливает метформин-индуцированное ингибирование роста клеток рака груди. Во-вторых, применение метформина радикально снижает уровень белка HER2 (на 85%). Метформин-индуцированное ингибирование HER2 происходит независимо от молекулярного механизма, приводящего к гиперэкспрессии HER2 (т.е. человеческая HER2 кДНК запускается вирусным промотором, что приводит к амплификации (увеличению числа копий) гена HER2). Метформин-индуцированное подавление гиперэкспрессии HER2 происходит через AMPK-независимое ингибирование активности p70S6K1, которая является эффектором mTOR.
Сочетание кРНК (cRNA, РНК, полученная от кДНК) и миРНК (siRNA)-индуцированной блокады активности/экспрессии AMPK не предотвращает анти-HER2 эффект, в то время как гиперактивация AMPK после действия аналога АМФAICAR является недостаточной для подавления гиперэкспрессии HER2. HER2-положительные клетки рака груди, подвергнутые трасфецированию siRNA p70S6K1, становятся невосприимчивыми к метформин-индуцированной супрессии. К тому же инкубирование с веществами, подавляющими продукцию активных форм кислорода (АФК) (например, N-ацетилцистеином), значительно усиливает способность метформина снижать экспрессию HER2 [44,45]. Эти данные позволяют предполагать, что метформин можно использовать в качестве профилактического средства для HER2-положительного рака груди.
Кроме того, присутствие или отсутствие таких молекулярных маркеров, как гиперэкспрессия HER2 и/или гиперактивация p70S6K1, может определять отличия в ответе на терапию метформином на ранних стадиях рака груди. Усиление ингибирования mTOR/p70S6K1 в сочетании с подавлением продукции АФК представляет собой ранее неизвестную связь антивозрастного и антиопухолевого действия метформина.
В настоящее время, по мнению M.V. Blagosklonny [46], задача состоит в том, чтобы определить минимальные дозы метформина (и особенно для комбинации с низкими дозами рапамицина), пригодные для клинического использования с целью торможения процесса старения, не вызывая побочных эффектов.
Литература
1. Anisimov V. N. Life span extension and cancer risk: myths and reality // Exp. Geront. 2001. Vol. 36. P. 1101-1136.
2. Melov S., Ravenscroft J., Malik S. et al. Extension of life-span with superoxide dismutase/catalase mimetics // Science. 2000. Vol. 289. P. 1567-1569.
3. Blagosklonny M.V. An anti-aging drug today: from senescence-promoting genes to anti-aging pill // Drug Discov Today. 2007 Mar;12(5-6):218-24.
4. Olshansky S. J., Hayflick L., Carnes B. A. No truth to the fountain of youth // Sci. Amer. 2002. Vol. 286. P. 92-95.
5. Spindler S. R. Caloric restriction, longevity and the search for authentic anti-aging drugs // In: Anti-aging therapy for plastic surgery / Eds B. Kinney and J. Carraway. St. Louis: Quality Medical Publishing Inc., 2003. P. 63-72.
6. Neafsey P. J. Longevity hormesis. A review // Mech. Aging Dev. 1990. Vol. 51. P. 1-31.
7. Mattson M. P. Hormesis and disease resistance: activation of cellular stress response pathways // Hum. Exp. Toxicol. 2008. Vol. 27. P. 155-162.
8. Cook R., Calabrese E. The importance of hormesis to public health // Environm. HlthPerspect. 2006. Vol. 114. P. 1631-1635
9. Le Bourg E., Rattan S. I. S. Hormesis and aging: What’s the deal? // In: Mild Stress and Healthy Aging. Eds. Eric Le Bourg and Suresh I. S. Rattan. Netherlands: Springer, 2008. P. 1-4.
10. Gems D., Partridge L. Stress-response hormesis and aging: «that which does not kill us makes us stronger» // Cell Metab. 2008. Vol. 3. P. 200-203. Rattan S. I. S. Hormetic interventions in aging // J. Pharmacol. Toxicol. 2008. Vol. 3. P. 27-40.
11. Mattson M. P. Hormesis and disease resistance: activation of cellular stress response pathways // Hum. Exp. Toxicol. 2008. Vol. 27. P. 155-162.
12. Vaiserman A. M. Irradiation and hormesis // In: Mild stress and healthy aging: Applying hormesis in aging research and interventions / Eds E. Le Bourg and S. I. S. Rattan. Dordrecht, Netherlands: Springer, 2008. P. 21-41.
13. Cook R., Calabrese E. The importance of hormesis to public health // Environm. HlthPerspect. 2006. Vol. 114. P. 1631-1635.
14. Minois N. Longevity and aging: beneficial effects of exposure to mild stress // Biogerontology. 2000. Vol. 1. P. 15-29.
15. Neafsey P. J. Longevity hormesis. A review // Mech. AgingDev. 1990. Vol. 51. P. 1-31.
16. Кольтовер В. К. Свободнорадикальная теория старения: исторический очерк // Успехи геронтол. - 2000. - Т. 4. - С. 33-40.
17. Aliste A. J., Del Mastro N. L. Ascorbic acid as radiation protector on polysaccharides used in food industry // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2004. Vol. 249. P. 131-133.
18. Smith D.L. Jr., Nagy T.R., Allison D.B. Calorie restriction: what recent results suggest for the future of ageing research // Eur J Clin Invest. 2010 May;40(5):440-50.
19. Ingram D.K., Anson R.M., de CR, Mamczarz J., Zhu M., Mattison J., Lane M.A., Roth G.S. Development of calorie restriction mimetics as a prolongevity strategy. // Ann N Y Acad Sci. 2004;1019:412-423;
20. Ingram D.K., Zhu M., Mamczarz J., Zou S., Lane M.A., Roth G.S., de Cabo R. Calorie restriction mimetics: an emerging research field. Aging Cell. 2006;5:97-108;.
21. Roth G.S., Ingram D.K., Lane M.A. Caloric restriction in primates and relevance to humans. // Ann N Y Acad Sci. 2001;928:305-315.
22. Selman C., Tullet J.M., Wieser D., Irvine E., Lingard S.J., Choudhury A.I., Claret M., Al-Qassab H., Carmignac D., Ramadani F., Woods A., Robinson I.C., Schuster E., Batterham R.L., Kozma S.C., Thomas G., Carling D., Okkenhaug K., Thornton J.M., Partridge L., Gems D., Withers D.J. Ribosomal protein S6 kinase 1 signaling regulates mammalian life span. // Science.2009; 326: 140-144.
23. Radziuk J., Bailey C.J., Wiernsperger N.F., Yudkin J.S. Metformin and its liver targets in the treatment of type 2 diabetes. // Curr Drug Targets Immune Endocr Metabol Disord. 2003;3:151-169.
24. Dhahbi J.M., Mote P.L., Fahy G.M., Spindler S.R. Identification of potential caloric restriction mimetics by microarray profiling. // PhysiolGenomics. 2005 Nov 17;23:343-350.
25. Onken B., Driscoll M. Metformin induces a dietary restriction-like state and the oxidative stress response to extend C. elegansHealthspan via AMPK, LKB1, and SKN-1. PLoS ONE. 2010;5:e8758.
26. Anisimov V.N., Semenchenko A.V., Yashin A.I. Insulin and longevity: antidiabeticbiguanides as geroprotectors. // Biogerontology. 2003;4:297-307.;
27. Anisimov V.N. Effect of buformin and diphenylhydantoin on the life span, estrous function and spontaneous tumor incidence in rats. // Vopr Onkol. 1980;26:42-48.
28. Ma T.C., Buescher J.L., Oatis B., Funk J.A., Nash A.J., Carrier R.L., Hoyt K.R. Metformin therapy in a transgenic mouse model of Huntington's disease. // Neurosci Lett. 2007 Jan 10;411:98-103.
29. Smith D.L. Jr., Nagy T.R., Allison D.B. Calorie restriction: what recent results suggest for the future of ageing research // Eur J Clin Invest. 2010 May;40(5):440-50.
30. Anisimov V.N., Piskunova T.S., Popovich I.G., Zabezhinski M.A., Tyndyk M.L., Egormin P.A., Yurova M.V., Rosenfeld S.V., Semenchenko A.V., Kovalenko I.G., Poroshina T.E., Berstein L.M. Gender differences in metformin effect on aging, life span and spontaneous tumorigenesis in 129/Sv mice // Aging (Albany NY). 2010 Dec;2(12):945-58.
31. Anisimov V.N. Metformin for aging and cancer prevention // Aging (Albany NY). 2010 Nov;2(11):760-74.
32. Dilman V.M., Anisimov V.N. Effect of treatment with phenformin, dyphenylhydantoin or L-DOPA on life span and tumor incidence in C3H/Sn mice. // Gerontology. 1980;26:241-245.
33. Anisimov V.N., Berstein L.M., Egormin P.A., Piskunova T.S., Popovich I.G., Zabezhinski M.A., Kovalenko I.G., Poroshina T.E., Semenchenko A.V., Provinciali M., Re F., Franceschi C. Effect of metformin on life span and on the development of spontaneous mammary tumors in HER-2/neu transgenic mice. // ExpGerontol. 2005;40:685-693.
34. Anisimov VN, Egormin PA, Piskunova TS, Popovich IG, Tyndyk ML, Yurova MN, Zabezhinski MA, Anikin IV, Karkach AS, Romanyukha AA. Metformin extends life span of HER-2/neu transgenic mice and in combination with melatonin inhibits growth of transplantable tumors in vivo. Cell Cycle. 2010;9:188-197.
35. Anisimov V.N., Berstein L.M., Egormin P.A., Piskunova T.S., Popovich I.G., Zabezhinski M.A., Tyndyk M.L., Yurova M.N., Kovalenko I.G., Poroshina T.E., Semenchenko A.V. Metformin slows down aging and extends life span of female SHR mice. // Cell Cycle. 2008;7:2769-2773.
36. Popovich I.G., Zabezhinski M.A., Egormin P.A., Tyndyk M.L., Anikin I.V., Spasov A.A., Semenchenko A.V., Anisimov V.N. Insulin in aging and cancer: new antidiabetic drug Diabenol as geroprotector and anticarcinogen. // Int J Biochem Cell Biol. 2005;37:1117-1129.
37. Ma T.C., Buescher J.L., Oatis B., Funk J.A., Nash A.J., Carrier R.L., Hoyt K.R. Metformin therapy in a transgenic mouse model of Hungtington's disease. //Neurosci Lett. 2007;411:98-103.
38. Anisimov V.N., Piskunova T.S., Popovich I.G., Zabezhinski M.A., Tyndyk M.L., Egormin P.A., Yurova M.V., Rosenfeld S.V., Semenchenko A.V., Kovalenko I.G., Poroshina T.E., Berstein L.M. Gender differences in metformin effect on aging, life span and spontaneous tumorigenesis in 129/Sv mice // Aging (Albany NY). 2010 Dec;2(12):945-58.
39. Anisimov V.N., Semenchenko A.V., Yashin A.I. Insulin and longevity: antidiabeticbiguanides as geroprotectors. // Biogerontology. 2003;4:297-307.
40. Smith D.L., Elam C.F., Mattison J.A., Lane M.A., Roth G.S., Ingram D.K., Allison D.B. Metformin supplementation and life span in Fischer-344 rats. // J. Gerontol. Biol. Sci. 2010;65A:468-474.
41. Abbatecola A.M., Lattanzio F., Molinari A.M., Cioffi M., Mansi L., Rambaldi P., DiCioccio L., Cacciapuoti F., Canonico R., Paolisso G. Rosiglitazone and cognitive stability in older individuals with type 2 diabetes and mild cognitive impairment // Diabetes Care. 2010 Aug;33(8):1706-11.
42. Vazquez-Martin A., Oliveras-Ferraros C., Menendez J.A. The antidiabetic drug metformin suppresses HER2 (erbB-2) oncoprotein overexpression via inhibition of the mTOR effector p70S6K1 in human breast carcinoma cells // Cell Cycle. 2009 Jan 1;8(1):88-96.
43. Anisimov V.N. Metformin for aging and cancer prevention // Aging (Albany NY). 2010 Nov;2(11):760-74.
44. Menendez J.A., Cufi S., Oliveras-Ferraros C., Vellon L., Joven J., Vazquez-Martin A. Gerosuppressant Metformin: less is more // Aging (Albany NY). 2011 Apr;3(4):348-62.
45. Chan N.N., Feher M.D. Metformin and ageing diabetic patients // Age Ageing. 2000 Mar;29(2):187.
46. Blagosklonny M.V. Metformin and sex: Why suppression of aging may be harmful to young male mice // Aging (Albany NY). 2010 Dec;2(12):897-9.


