
|
|
 |
|||||||||
| |||||||||
|
Биоревитализация с помощью молодой, здоровой крови и трансплантация стволовых клеток
В 2010 году ученые, Гарварда выявили, что кровь молодых лабораторных животных способна остановить и даже повернуть вспять признаки старения, попав в кровеносную систему старших собратьев. В ходе экспериментов исследователи соединили кровеносные системы двух особей грызунов так, чтобы кровь взрослых животных подвергалась воздействию молекул и клеток, содержащихся в крови молодых мышей.  "Некоторые возрастные процессы обратимы, и молекулы, способные остановить старение, обнаружены в крови, - рассказала исследователь Института стволовых клеток Гарварда Эми Уоджерс. - Открытие может подсказать, как повысить сопротивление инфекциям, и, возможно, уменьшить риск некоторых раковых образований". Как ни странно, но метод обменного переливания крови существует уже много десятилетий, является рутинной медицинской процедурой. Основоположником этого направления является русский ученый-естествоиспытатель Александр Богданов. 26 февраля 1926 года по инициативе Александра Богданова (Малиновского) в Москве был открыт первый в мире Институт переливания крови. Сам Александр Богданов (1873-1928) и стал его первым директором. Богданов усиленно интересовался эффектами взаимных переливаний крови (пол-литра - литр) между больными и между больными и здоровыми людьми. Один из его сотрудников, академик Академии Наук СССР с 1932 года, А.А. Богомолец (1881-1946), в памятной статье о Богданове высоко отозвался о его концепции обмене кровью. В 1928 г. он писал: «Особое место в работах А.А. Богданова занимает проблема борьбы с изношенностью организма посредством «обменных переливаний крови». Таким образом, «кровь, как разновидность соединительной ткани, по мысли Богомольца, вполне могла быть омоложена». В настоящее время эксперименты показали, что применение экстрокорпоральных методов очищения и переливания крови от здорового, молодого донора с одновременным выполнение процедуры экстракорпоральной и внутрисосудистой фотомодификации крови модулированным лазерным излучением дает выраженные положительные результаты при:
Кроме того, может с успехом применяться под контролем клинических анализов, для ревитализации (омоложения) организма. Переливание крови (компонентов крови) от молодого, здорового донора реципиентуПереливание крови подразумевает удаление части крови из кровеносного русла пожилого, отягощенного хроническими заболеваниями пациента с одновременным замещением её на кровь молодого, здорового донора в равном соотношении, от 100 мл до 1 л. Естественно, предполагается полная совместимость донора и реципиента по различным системам: AB0, Келл, резус-фактора и т. д. При участии в специальных программах ревитализации дополнительно проводится исследование KIR системы и HLA II класса. Плазмаферез
Плазмаферез - очищение организма, посредством удаления из крови ее жидкой части (плазмы) содержащей патологические продукты. Плазмаферез отличается от кровопускания временным удалением части крови (в конце процедуры форменные элементы возвращаются в кровеносное русло). В результате проведения плазмафереза, активизируется система защиты, в ответ на удаление части крови, без последствий потери жизненно важных форменных элементов крови. Лечебное действие плазмафереза основано на возможности удаления из организма вместе с плазмой избыточного количества патологических продуктов, играющих патогенетическую роль в развитии заболеваний и их осложнений. Плазмаферез, как универсальный метод эфферентный терапии, способствует выработке стойкой иммунной защиты организма. После удаления плазмы сгущенная клеточная масса крови («эритромасса») разводится изотоническим раствором натрия хлорида и возвращается пациенту. Для полноценной санации внутренней среды обычно требуется 2-3 сеанса плазмафереза, за которые удаляется в общей сложности 1-2 объема циркулирующей плазмы (ОЦП). Рассчитать ОЦП можно индивидуально, исходя из того, что на 1 кг массы тела у мужчин приходится 43 мл. плазмы, а у женщин - 41 миллилитр. Интервалы между процедурами составляют 1-2 дня. При таком режиме, даже при замещении плазмы только изотоническим раствором натрия хлорида, не наступает каких-либо существенных сдвигов основных компонентов внутренней среды (белков, жиров, углеводов, электролитов, гормонов и т. п.). ПлазмолифтинПлазмолифтинг - метод инъекционного введения в ткани организма богатой тромбоцитами плазмы, полученной из крови самого пациента. Данная методика может эффективно применяться в различных областях медицины, в частности в хирургической стоматологии при имплантации зубов. Плазмолифтинг ускоряет процесс остеоинтеграции (сращения поверхностей имплантата с костной тканью) и регенерации тканей десны. Вышеуказанные свойства плазмолифтинга эффективно используются при лечении пародонтита и пародонтоза. В косметологии плазмолифтинг применяется для борьбы со старением кожи, в частности для разглаживания морщин, улучшения состояния кожи, последствиями избыточной инсоляции. Методика эффективна и для лечения выпадения волос. Богатая тромбоцитами плазма позволяет остановить отмирание волосянных фолликулов, истончение волос и стимулировать рост. Более выраженные результаты отмечаются при использовании тромбоцитарной массы молодых доноров. Клеточная терапия и репрограммирование стволовых клеток
Стволовые клетки - это иерархия особых клеток живых организмов, каждая из которых способна впоследствии изменяться (дифференцироваться) особым образом (то есть получать специализацию и далее развиваться как обычная клетка). Дальнейшая специализация стволовых клеток определяется набором стимулов, с которыми эта клетка встречается в организме. Эти стимулы могут быть биологическими (влияние микроокружения) или физическими (электромагнитное излучение). Отличие стволовых клеток состоит в том, что они могут делиться относительно неограниченно, пока не "превратятся" в зрелые, а зрелые клетки обычно имеют ограниченное количество циклов деления. Убедительно доказано, что из этих клеток происходят не только все ростки кроветворения, но и другие клетки организма. При определенных условиях из стволовой клетки крови можно получить клетку скелетной мускулатуры, клетку сердечной мышцы, вырастить настоящую кость и хрящ, и, даже, вырастить клетку головного мозга - нейрон. Эти лабораторные данные нашли свое применение в клинике. С помощью трансплантации клеток крови делаются первые шаги в лечении заболеваний скелетных мышц (миопатия Дюшена), эндокринной патологии (сахарный диабет), дегенеративных болезней центральной нервной системы (болезнь Альцгеймера, рассеянный склероз, болезнь Паркинсона). Лечение острого инфаркта миокарда и инсульта с применением стволовых клеток вышло за рамки эксперимента и вошло в клиническую практику. Периодические переливания клеток, полученных на ранних этапах жизни, могут способствовать замедлению процессов старения. Источники стволовых клетокНаиболее богата стволовыми клетками пуповинная кровь новорожденного. Эти стволовые клетки, кроме прочего, имеют наибольшую способность к делению и специализации, и не подверглись влиянию внешней и внутренней среды. Существует представление, что стволовые клетки не стареют, это не так, они тоже стареют, но значительно медленнее, по этому очень важно, когда именно вы заготовили свои стволовые клетки - чем раньше, тем лучше!
Вторым источником стволовых клеток является костный мозг человека. При определенных условиях стволовые клетки выходят в периферическую кровь и циркулируют там непродолжительное время. За последние два десятилетия разработана методика, позволяющая получать стволовые клетки из крови и хранить их длительно без потери свойств. Эта методика предусматривает предварительную стимуляцию кроветворения донора для увеличения содержания интересующих клеток в кровотоке в десятки раз и их забор с помощью клеточного сепаратора крови. По мере старения организма капитал стволовых клеток истощается, существенно снижается их способность к делению, замедляются процессы жизнедеятельности, что приводит к нарушению функций органов и систем, старению организма, может являться причиной возникновения опухолей. Чем раньше собраны и законсервированы стволовые клетки, тем больше их потенциал в плане восстановления утраченных функций. Таким образом, каждый человек может стать донором стволовых клеток для самого себя. Эффективность клеточной терапии показана и доказана в следующих областях медицины:
Клинические испытания, проведенные за последние десятилетие, расширили показания к клеточной терапии и позволили ее внедрить в:
Также получены положительные результаты применения стволовых клеток в комплексном лечении врожденных заболеваний (болезни накопления, пример болезнь Гоше, Неймана-Пика). Получение стволовых клеток из пуповинной крови
Пуповинная кровь принадлежит новорожденному ребенку и содержит в несколько раз больше стволовых клеток, которые находятся на разных степенях зрелости, чем кровь взрослого человека. Сбор пуповинной крови после рождения ребенка - уникальная, однократная возможность обеспечить запас стволовых клеток без каких-либо медицинских манипуляций и введения препаратов. Преимущества пуповинной крови.
Краткое описание метода получения клеток пуповинной крови.Сбор пуповинной крови осуществляется после рождения ребенка и отделения его от пуповины. Ни мать, ни ребенок не испытывают болевых ощущений. В ряде случаев возможен забор пуповинной крови и после отделения плаценты, если нет сомнения в ее целостности. Кровь собирается в специальную систему с консервантом путем пункции иглой вены пуповины. После того как кровь перетечет из пуповины в специальную систему, ее доставляют в лабораторию для обработки, выделения клеток их консервирования и длительного хранения. Методы сепарации (сбора) собственных стволовых клеток крови
Получение гемопоэтических стволовых клеток из периферической кровиМобилизация стволовых клеток в периферическую кровь: с целью увеличения количества стволовых клеток в периферической крови донор получает 8 инъекций гранулоцитарного колониестимулирующего фактора (Г-КСФ), подкожно с интервалом в 10-12 часов в течение 4 дней. Обычная подкожная инъекция, аналогичная таковой при введении инсулина у пациентов с сахарным диабетом. От этой процедуры может появиться ощущение «распирания» в костях или мышцах, которые проходят самостоятельно после прекращения введения лекарства. В день выполнения процедуры с помощью 2-х внутривенных игл донора подключают к специальному аппарату - сепаратору крови, который и будет выделять гемопоэтические клетки. Сама процедура продолжается от 2 до 6 часов (в зависимости от возраста и иных особенностей пациентиа и используемой аппаратуры) часов, в течение которых донор находится в относительно неподвижном состоянии (однако он может читать, смотреть телевизор или принимать пищу). Никаких болезненных или неприятных ощущений при этом не бывает. Во время процедуры через сепаратор несколько раз пропускается кровь донора и аппарат автоматически отделяет стволовые гемопоэтические клетки в контейнер. Все последующие манипуляции проводятся в стерильных условиях лаборатории с последующей криоконсервацией. Способ получения гемопоэтических стволовых клеток из костного мозгаВ операционной, под наркозом у него с помощью проколов в нескольких местах подвздошной и крестцовой костей забирают незначительное количество костного мозга, который после этого помещают в специальный контейнер. Операция продолжается в среднем 30-40 минут. Все последующие манипуляции (клонирование) проводятся в стерильных условиях лаборатории в течение нескольких недель или месяцев с последующей криоконсервацией. Если получение стволовых клеток у пациента невозможноНе смотря на то, что в настоящее время существует большое количество методов получения стволовых клеток из разных тканей организма (жировая ткань, дерма) иногда приходится прибегать к донорской трансплантации. Благоприятный прогноз трансплантации выше при наибольшем сходстве донора и реципиента по антигенам тканевой совместимости (HLA - human leucocyte antigens - антигены тканевой совместимости, человеческие лейкоцитарные антигены). Подобрать донора, полностью совместимого с реципиентом по антигенам HLA, очень сложно, поскольку число комбинаций, составленных более чем из 100 антигенов этого семейства, чрезвычайно велико. Вероятность подбора полностью совместимого донора среди родных братьев и сестер составляет 1:4, так как гены HLA наследуются по законам Менделя. При наследовании HLA - антигенов ребенок получает по одному гену каждого локуса от обоих родителей, т.е. половина антигенов тканевой совместимости наследуется от матери и половина от отца. Для подбора доноров существуют специальные базы данных и Банки стволовых клеток. Во время выполнения указанных процедур в систему переливания (трансфузии) добавляется дополнительно устройство сопряжения (оптический волновод) посредством которого осуществляется облучение крови в потоке модулированным лазерным излучением с особыми параметрами. Подробнее: см.«Физические методы».
ВСЕ ПРОЦЕДУРЫ ВЫПОЛНЯЮТСЯ НА БАЗЕ ЛИЦЕНЗИРОВАННОГО ПРОФИЛЬНОГО МЕДИЦИНСКОГО УЧРЕЖДЕНИЯ В СТЕРИЛЬНЫХ УСЛОВИЯХ, С ПРИМЕНЕНИЕМ ТОЛЬКО ОДНОРАЗОВЫХ СТЕРИЛЬНЫХ МАТЕРИАЛОВ, С ИСПОЛЬЗОВАНИЕМ ЦЕЛЬНОЙ КРОВИ (КОМПОНЕНТОВ КРОВИ) СИСТЕМАТИЧЕСКИ ОБСЛЕДУЕМЫХ ЗДОРОВЫХ И МОЛОДЫХ (18 ЛЕТ) ДОНОРОВ НЕ ПРИНИМАЮЩИХ АЛКОГОЛЬ, НАРКОТИЧЕСКИЕ ВЕЩЕСТВА, НЕ ИМЕЮЩИХ ГЕНЕТИЧЕСКИ ОБУСЛОВЛЕННЫХ ЗАБОЛЕВАНИЙ.Показания

Метод экстракорпоральной и внутрисосудистой фотомодификации крови модулированным лазерным излучением является новым вариантом широко применяемой в течение последних тридцати лет и введенной в медицинскую практику вариантом внутривенного лазерного облучения крови низкоинтенсивным лазерным излучением. Разница состоит в характере транслируемого (промодулированного особым образом лазерного излучения) в случае с квантовым характером воздействия и акустическим, если речь идет о применении электромагнитного излучения акустического диапазона. ПРИМЕНЕНИЕ КВАНТОВЫХ ГЕНЕРАТОРОВ
ИНВАЗИВНЫЙ: В первом случае, процедура выполняется в условиях амбулаторного приема (процедурный кабинет) с использованием специальной медицинской аппаратуры (лицензированный вид медицинской деятельности) в виде нескольких циклов из сеансов различной продолжительности от 10 минут до 45 и более. При выполнении процедуры используются только одноразовые стерильные материалы. Во время процедуры в локтевую вену, как при стандартном заборе крови на лабораторное исследование, вводится обычная внутривенная игла с той разницей, что внутри игла не полая, а содержит специальный стерильный волновод по которому луч лазера проникает в вену. 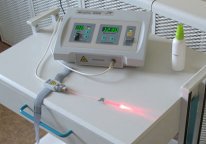
НЕИНВАЗИВНЫЙ (ЧРЕСКОЖНЫЙ): В этом случае, на поверхности тела пациента закрепляется специальная лазерная излучающая головка, которая оказывает воздействие без нарушения целостности кожных покровов. ПРИМЕНЕНИЕ АКУСТИЧЕСКИХ УСТРОЙСТВВо втором случае, (не лицензированный вид деятельности) речь идет о записи электромагнитного излучения на воспроизводящее акустические сигналы в широкой полосе частот устройство для последующего самостоятельного прослушивания в течение 28 минут ежедневно в течение длительного времени (в зависимости от цели). СПЕЦИАЛЬНАЯ ПОДГОТОВКАВ случае со стандартной процедурой ВЛОК специальная подготовка не требуется, но в данном случае применяется технология, которая требует предварительной сдачи специальных анализов. Самый простой вариант - воспользоваться лабораторией «Инвитро», филиалы которой имеются во многих городах России. При наличии однополых, практически здоровых родственников в возрастной группе от 12 до 20 лет необходимо провести исследования и им. Для проведения процедуры необходимо сдать следующие анализы:
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Не смотря на то, что список показаний для ВЛОК обширен и является рутинным методом физиотерапии, новый метод экстракорпоральной и внутрисосудистой фотомодификации крови модулированным лазерным излучением рассматривается для:
КВАНТОВАЯ ТЕРАПИЯ В КЛИНИЧЕСКОЙ ОНКОЛОГИИИзучение эффективности квантового излучения в онкологии было начато в РОНЦ РАМН в начале 80-х гг. Была доказана высокая эффективность квантового излучения (КИ) при лечебной эндоскопии у больных предопухолевыми заболеваниями. Как известно, одним из настораживающих моментов в течение хронических воспалительных заболеваний является изменение структуры пораженной ткани, или дисплазия. КИ предотвращает прогрессирование и в большом проценте случаев способствует обратному развитию структурных изменений в тканях на фоне хронического воспаления, что с успехом применяется в лечении предраковых заболеваний женской половой сферы, желудочно-кишечного тракта и дыхательных путей. Исследование КИ, проведенное в Онкологическом центре с целью изучения влияния лазерного излучения на показатели клеточного и гуморального иммунитета, показало его высокое потенцирующее действие на стимуляцию реактивности организма у онкологических больных (Трапезников Н.Н. с соавт. 1985). Там же разработан метод адаптивной фотоиммунотерапии. Он заключается в лазерном облучении и последующей реинфузии выделенных из крови лимфоцитов. При раке молочной железы, в результате такого лечения, отмечено увеличение количества Т-лимфоцитов и естественных киллеров. Изучение роли воздействия КИ в метаболической корреляции тканевой гипоксии у больных со злокачественными новообразованиями до операции и в раннем послеоперационном периоде выявило высокую эффективность этого метода, как по профилактике послеоперационных осложнений, так и по улучшению результатов лечения. Интересны результаты исследования, полученные в ходе лечения генерализованной формы рака молочной железы путем воздействия КИ на циркулирующую лимфу. Воздействие КИ проводилось в течение 60 мин. ежедневно на протяжении 5 дней. Анализ лимфы на уровень содержания молекул средней массы, молочной кислоты, молонового диальдегида после воздействия КИ свидетельствовал о снижении этих показателей в 2-6 раз. В лаборатории клеточного иммунитета проведено изучение влияния лазерного излучения на цитотоксическую активность мононуклеарных клеток (МНК) доноров. Доказана способность МНК высвобождать цитокины ИЛ-1 и ФНО. В Онкологическом научном центре РАМН также проводилось изучение возможности коррекции тканевой гипоксии КИ как самостоятельно, так и в сочетании с комплексом биоантиоксидантов в пред- и в раннем послеоперационном периоде. Предоперационная терапия позволила добиться снижения интенсивности процессов перекисного окисления липидов, при этом уменьшалась внутриклеточная гипоксия, улучшалось функциональное состояние клеток, органов и систем у 90% больных раком легкого, 80% больных раком кардиального отдела желудка и у 70% больных раком пищевода. Изменилась структура осложнений в раннем послеоперационном периоде. Ни в одном случае не наблюдалось тромбоэмболии легочной артерии, снизилась частота гнойно-септических осложнений, пневмоний, трахеобронхитов, тромбофлетов. Послеоперационная летальность снизилась на 6% раке кардиального отдела желудка, на 12% при раке пищевода (Свиридова С.П. с совт.1991). В НИИ онкологии им. П.А. Герцена методики квантовой терапии применяются в пред- и послеоперационном периоде и интраоперационно при заболеваниях сердечно-сосудистой системы, при заболеваниях органов дыхания и пищеварительной системы, а также с целью обезболивания, профилактики и лечения различных осложнений комбинированной терапии. Исследователи считают принципиальным тот факт, что по результатам лечения свыше 1000 больных не отмечено ни одного случая обострения основного заболевания и каких-либо побочных реакций. (Кабисов Р.К. с соавт. 1996). Коченов В.И. (1991) делится наблюдениями по использованию КИ в послеоперационном периоде более чем у 300 пациентов. Квантовая терапия (КТ) после операций по поводу рака голосовой связки при прямой опорной микроларингоскопии позволяла в 1,5-2 раза ускорить заживление и эпителизацию, в том числе после криодеструкции, сократить пребывание больных в стационаре, уменьшить дозы и сроки антибиотикотерапии, улучшить качество функциональной реабилитации. Клинико-морфологические, иммуноморфологические и гистохимические исследования тканей глотки проведенные в 1ЛМИ им.И.П.Павлова показало, что КИ приводит к повышению местного тканевого иммунитета, нормализации метаболических процессов в эпителии слизистой оболочки глотки, усилению регенерационных процессов. Стимуляция заживления тканей после лучевых ожогов, регенерация нервных волокон, уменьшение микрофлоры в инфицированных ранах, наступающих под воздействием КИ, дает основание к широкому применению низкоинтенсивных лазеров при лечении послеоперационных осложнений. Репараторные и бактериостатические возможности, стимулируемые КИ, дают основание к его применению в послеоперационном периоде для ускорения заживления ран, профилактики келлоидных рубцов (или их лечения). Отмечено, что при облучении ран, значительно ускоряется эпителизация, увеличивается прочность рубца линейных ран на разрыв. При лечении гранулирующих ран, зафиксирован выраженный стимулирующий эффект КИ на макрофагально-гистиоцитарную систему. Рост грануляций и эпителизация ускоряется в 2 раза по сравнению с контрольной группой. Келлоидные рубцы при этом не развиваются. Интересные результаты были получены при лечении больных раком молочной железы IIа-IIIа ст. Воздействие квантовым излучением осуществлялось в до- и послеоперационном периоде с повторением курсов лазерной терапии (длина волны ИК-излучения 0,89 мкм) в последующие сроки наблюдения. По сравнению с контрольной группой, количество послеоперационных осложнений снизилось на 15%. 5-летнее наблюдение за больными показало, что выживаемость в группе больных, получавших лазерную терапию, составила 100% при IIа ст., и 94,4% при IIIа ст. В контрольной группе - соответственно 85,7% и 78,9%. Безрецидивное течение при заболевании IIа ст. - 91,3%, при IIIa ст.- 82,4%. В контрольной группе - соответственно 77,7 и 60%. При квантовом облучении костного мозга отмечено, что уже через час возрастает число клеток эритроидного и миелоидного ряда, число митозов, а также усиливаются процессы дифференциации. Через сутки увеличивается число полиморфно-ядерных клеток миелоидного ряда и нейтрофильных лейкоцитов в периферической крови. Одними из первых исследователей, проводивших изучение эффективности лазерного облучения крови у онкологических больных, были ученые Томского НИИ онкологии. При отработке режима сеансов лазерной терапии использовалась экспозиция в 30 мин (для одной группы больных) и 60 мин (для другой группы больных), ежедневно в течение 5 дней. Существенных различий в этих группах больных не выявлено. Не зафиксировано никаких осложнений и побочных проявлений. Отмечено ускорение репарации послеоперационных ран, а анализ отдаленных результатов показал, что частота и сроки возникновения рецидивов в группе больных, которым проводилось лазерное облучение крови, достоверно ниже сравнительно с контрольной группой. В НИИ детской онкологии и гематологии РОНЦ РАМН проводилось изучение эффективности КГ посредством исследования динамики клеточного иммунитета у детей, получавших химиотерапию по поводу различных злокачественных новообразований. Воздействие КИ осуществлялось на крупные сосуды сонных артерий, в кубитальных, подключичных и подколенных областях. Частота КИ 50 Гц, длительность сеанса для детей старшего возраста составляла 5-10 мин. (облучение крови осуществлялось двумя терминалами-излучателями одновременно). Курс терапии содержал от двух до трех-четырех сеансов. У больных, получивших свыше двух сеансов, установлено повышение числа зрелых Т-лимфоцитов, Т-супрессоров и лимфоцитов. Отмечена положительная динамика, осложнений и побочных проявлений не выявлено. НИЛИ не только не оказывает видимого повреждающего действия на клетки крови и не изменяет их жизнеспособность, но предотвращает или даже уменьшает их повреждение цитостатиками (Алиханов Б.А.,Токмачев Ю.К., 1993). Угнетение метастазирования, а в ряде случаев и полное подавление опухолевого роста при воздействии НИЛИ, описано Димант И.Н. с соавт. (1991). Ими показано, что излучение гелий-неонового лазера с длиной волны 632 нм приводит к некрозу опухоли и разрастанию соединительной ткани с развитием выраженных дистрофических процессов в клеточных элементах опухоли. Одновременно с этим отмечены изменения ферментативной активности в опухоли и окружающих нормальных тканях, нарастание активности щелочной фосфатазы, сукцинатдегидрогеназы и кислой фосфатазы в нейтрофилах крови и снижение их активности в новообразовании. Этими же исследователями зафиксировано двукратное удлинение срока жизни животных, оперированных по поводу саркомы мягких тканей с воздействием НИЛИ на не радикально удаленную опухоль. Отмечено угнетение опухолевого процесса, уменьшение объема опухоли за счет дистрофических и склеротических процессов. При проведении экспериментальных исследований на крысах с перевиваемой саркомой Уокера и на мышах с раком молочной железы путем воздействия на новообразования полупроводниковым арсенид-галлиевым лазером с длиной волны 890 нм отмечено, что при суммарной дозе 0,46 Дж рост опухоли сокращался на 37,5%, а продолжительность жизни увеличилась в 1,2 раза. При суммарной дозе 1,5 Дж размеры опухоли не отличались от контрольной группы. Также не было различий в продолжительности жизни. Многолетние исследования по влиянию НИЛИ на злокачественные опухоли, проведенные в Российском онкологическом научном центре РАМН А.В. Ивановым с соавт. (1993, 1999), доказали прямое ингибирующее действие НИЛИ на клетки опухоли. Они облучали асцитный вариант эмбриокарциномы в центрифужных пробирках и чашках Петри (лазер с длиной волны 1264 нм, мощностью 8,5 мВт, экспозиция 20 мин.). Облученный лазером материал вводили животным внутримышечно и внутрибрюшинно. При первом способе введения выявлено торможение роста опухоли на 80% от ее средней массы. При внутрибрюшной перевивке получены статистически достоверные данные по увеличению продолжительности жизни животных. Авторы делают вывод, что лазерное излучение с длиной волны 1264 нм оказывает прямое ингибирующее действие на рост опухолей. Наиболее эффективное торможение роста опухолей имеет место при многократном курсовом облучении и проявляется в ближайшее время после воздействия НИЛИ. При действии на суспензию опухолевых клеток (асцитный перевивочный материал) наблюдается их дозозависимая гибель. Воздействие на опухоли разных локализаций различается по эффективности, что предполагает разработку индивидуальных режимов воздействия для каждой нозологической формы. Излучение гелий-неонового лазера с мощностью непрерывного излучения 5-8 мВт удлиняет латентный период развития карциномы Льюиса и меланомы В-16, тормозит рост опухоли и снижает активность метастазирования. В структуре облученных опухолей определялись очаги полной гибели клеток, метастазы имели меньшие размеры, на 25 % увеличивалась колониеобразующая способность клеток костного мозга, продолжительность жизни облученных животных увеличивалась на 5-13 суток (Гамалея И.Ф. с соавт., 1988). Выраженные изменения в структуре первичной опухоли, вплоть до гибели клеточных элементов опухоли, зафиксированы при лазерном облучении крови. Метастазы у этих животных были значительно меньше сравнительно с контрольной группой (Гамалея Н.Ф. (1988). Интересные результаты были получены исследователями, изучавшими сочетанное воздействие НИЛИ и лучевой терапии на злокачественные новообразования. В проводимом эксперименте, лазерное облучение фибросаркомы (полупроводниковый лазер, 905 нм, частота повторения импульсов 265 Гц, мощность импульса 50 Вт, экспозиция 210 с.) не оказало влияния на рост опухоли, но потенцировало противоопухолевую активность рентгено- и радиотерапии (Larcovic N et al. ). Экспериментальные исследования на мышах линии С57В1.6, с перевитой карциномой Льюиса под кожу бедра, проводили Южаков В.В. и соавт. (1994). Животные подвергались локальному гамма-облучению в дозе 30 грей и инфракрасному (ИК) лазерному облучению (10 кГц, 5,4 мВт/см2, экспозиция 10 мин). За 5 мин до гамма-терапии на опухоль воздействовали НИЛИ. Через 3 суток после сочетанного воздействия в сохранившихся участках паренхимы опухоли сосудистая сеть оставалась полнокровной. По данным математического прогнозирования для опухолей изоэффективных объемов, воздействие лазерным излучением до гамма-облучения приводит к фактическому увеличению митотической активности через 3 суток, почти на 30%. Между тем, темп роста и абсолютный прирост массы опухоли практически не меняются. Дополнительная репопуляция клеток возникает преимущественно в переходных и ранее потенциально гипоксических зонах и, фактически, замещает гибнущую часть опухолевых клеток. Повышение митотической активности опухолевых клеток авторы расценивают как благоприятный прогностический признак, свидетельствующий об усилении степени оксигенации опухолевой ткани, и, соответственно, о снижении доли наиболее резистентных к гипоксии клеток. Этот фактор может расцениваться как особенно важный для эффективного подавления роста опухолей с медленной пострадиационной реоксигенацией и их разрушения при фракционированном режиме лучевого воздействия. В работе Мещериковой В.В с соавт. (РОНЦ РАМН) сравнивалась эффективность применения различных режимов лазерного воздействия при лечении лучевых реакций кожи стопы мышей. Стопу задней конечности мышей подвергали однократному рентгеновскому облучению, в дозе 36 грей или фракционированному облучению в дозе 45 грей. В день первого облучения, или спустя разные сроки после него, на зону облучения воздействовали квантовым излученикм (КИ). Воздействие проводили пять раз в неделю в течение двух недель, при этом варьировались частота и длительность лазерного воздействия, а также время начала лечения относительно момента рентгеновского облучения. Тяжесть лучевых реакций оценивали в относительных единицах в течение 30…50 суток после облучения. Воздействие импульсным инфракрасным лазером с длиной волны 0,89 мкм позволило существенно снизить тяжесть лучевых реакций. Например, после однократного облучения в дозе 36 грей, максимальная тяжесть реакции достигает 2,1 отн. ед., а длительность проявления 30 суток. В результате лечения максимальная тяжесть снижается до 0,6 отн. ед., а длительность проявления лучевых реакций составляет 20 суток. Первые исследования проводились только аппаратами, оснащенными низкоинтенсивными лазерными излучателями, отсюда аббревиатура НИЛИ. Современные аппараты оснащены излучателями красного света, инфракрасного и инфракрасного лазерного света, а также источником постоянного магнитного поля (ПМП). Излучение таких аппаратов принято называть квантовым излучением (КИ). Эффективность применения квантового воздействия повышается, если оно начинается до момента развития лучевых реакций. Лазерное воздействие уменьшает тяжесть лучевых реакций кожи мышей в пропорции, соответствующей двукратному снижению дозы рентгеновского облучения. Эффект облучения был проверен на рост солидной карциномы Эрлиха. Опухоль прививали под кожу бедра, спустя 8 дней ее подвергали однократному рентгеновскому воздействию, в дозе 36 грей, а затем в течение двух недель проводили 10 сеансов лазерного воздействия. Стимуляции роста опухоли при этом не наблюдалось. Полученные данные подтверждают имеющиеся в литературе данные о благоприятном воздействии инфракрасного лазерного излучения при лучевых поражениях кожи. Литература

|
Дизайн и поддержка: Interface Ltd. |
|