|
|
Материализация эпигенетики или Небольшие изменения с большими последствиями
доктор биологических наук Б. Ф. Ванюшин
XX век принёс нам множество грандиозных событий в естествознании, среди которых не последнее место занимает открытие двойной спирали ДНК. В прошлом году исполнилось ровно 50 лет с той поры, когда Уотсон и Крик (рис. 1) предложили миру структуру ДНК в виде необычной тогда двойной спирали. Исключительное значение этого события прежде всего в том, что они этой структурой объяснили миру, как происходит передача наследственных свойств. На деле реализовался принцип комплементарности (матриц), предложенный выдающимся русским естествоиспытателем Н.К. Кольцовым. Теперь каждому школьнику известно, что в ДНК существуют две „сладкие парочки" оснований аденин-тимин (AT) и гуанин-цитозин (ГЦ) (рис. 2): А в одной цепи ДНК соответствует Т в другой, аналогичным образом ведёт себя и другая пара ГЦ.
На примере ДНК принцип комплементарности проявляется в том, что одна половинка (цепочка) ДНК структурно дополняет другую. Поэтому ферменты по каждой из отдельных половинок (матриц) могут достроить недостающую половинку; таким образом, в клетке из одной двутяжевой молекулы ДНК возникают две дочерние, как две капли воды похожие на материнскую. Наконец-то обрёл осязаемые черты главный принцип генетики - наследственность. При этом материализовалась по-новому и сама генетика, появились молекулярная генетика и молекулярная биология.
Открытие двойной спирали стало торжеством единства науки, оно произошло благодаря объединённым усилиям и знаниям биологов, физиков, химиков, математиков. Поистине, межи науки - самые плодородные, и, возможно, в этом самый главный урок, который преподала нам двойная спираль: знания лучше объединять, а не делить.
Ответы и вопросы

Рис. 1 Дж.Уотсон и Ф.Крик, 1953 г. | Открытием двойной спирали ДНК началось победоносное и ошеломительное шествие науки, затронувшее все стороны нашей жизни. Я не берусь предсказывать, как дальше развернутся события в естествознании. Бесспорно одно: они будут разворачиваться гораздо быстрее и интенсивнее, чем до сих пор. Уже во весь голос заявили о себе целые новые области знания: геносистематика, геномика, протеомика, биоинженерия, биоинформатика, эпигенетика и другие. И в этом повинна ДНК. Так уж случилось, что у всех организмов наследственная информация записана именно в этой молекуле. (Вирусы, у которых эту роль могут выполнять РНК, - не организмы.) Никто не объяснит нам, почему природа в качестве наследственного материала выбрала ДНК, а не похожую на неё РНК. Может быть, это связано с тем, чтосахаро-фосфатный костяк у молекулы ДНК более устойчив, чем у РНК, - устойчивость важна для сохранения наследственности.
Как бы то ни было, ДНК - очень значимая биологическая субстанция. Благодаря расшифровке её структуры раскрыта природа генетического кода и мутаций, поняты причины многих наследственных болезней, сформированы обстоятельные представления о собственно организации генов и геномов, полностью расшифрована нуклеотидная последовательность геномов многих бактерий и пока ещё немногочисленных грибов, растений, животных и человека. Более того, мы научились конструировать принципиально новые гены и геномы и, главное, создавать трансгенные организмы. Многие из них (например, микробы) уже плодотворно трудятся на наше благо.
Однако достижения молекулярной биологии приносят всё больше вопросов. В частности, мы очень мало знаем о том, как работают гены, почему они молчат в одной клетке организма и активны в другой. Каковы молекулярные механизмы так называемой клеточной дифференцировки? Как заставить работать полезные гены или принудить их замолчать, если они вредны? Во многих случаях именно потому, что мы не знаем ответов на эти вопросы, новые гены, всаживаемые в клетку, неэффективны либо сильно искажают её природу.
Нельзя забывать, что у организмов существуют мощные регуляторные элементы (в геноме и на уровне клетки), которые контролируют работу генов. Эти сигналы накладываются на генетику и часто по-своему решают, „быть или не быть". Даже самая отличная генетика может вовсе и не реализоваться, если эпигенетика будет неблагополучной по образному выражению П. и Д. Медаваров, „генетика предполагает, а эпигенетика располагает".
Долгое время эпигенетику не признавали, стыдливо или даже намеренно умалчивали о ней - как правило, потому, что природа эпигенетических сигналов и пути их реализации в организме казались очень расплывчатыми. Считалось, что генетика - это святое, а эпигенетика - от лукавого.
Под эпигенетикой (не путать с теорией эпигенеза о появлении признаков в ходе развития организма de novo, в XVIII веке успешно противостоявшей преформизму) обычно понимают область знаний о совокупности свойств организма, которые не закодированы непосредственно в геноме, но могут и должны передаваться по наследству. К. Уодингтон, запустивший в обиход в сороковых годах прошлого века термин „эпигенетика", включает в неё и всё развитие организма. А в 1990 году Р. Холлидей писал „Эпигенетика может быть определена как изучение механизмов контроля активности генов во времени и пространстве в процессе развития сложных организмов". Он был в числе первых, кто указал на возможную биохимическую природу наследуемых эпигенетических сигналов.
Сегодня стало ясно, что один из таких сигналов - ферментативное (энзиматическое) метилирование самой генетической матрицы, то есть ДНК. Характер этой модификации генома наследуется, и она так или иначе контролирует все генетические процессы. Однако путь к расшифровке природы, специфичности и пониманию биологической роли этой модификации ДНК был очень непрост, и мы рады осознавать, что на этом трудном пути заметны и наши вехи.
Мал золотник, да дорог
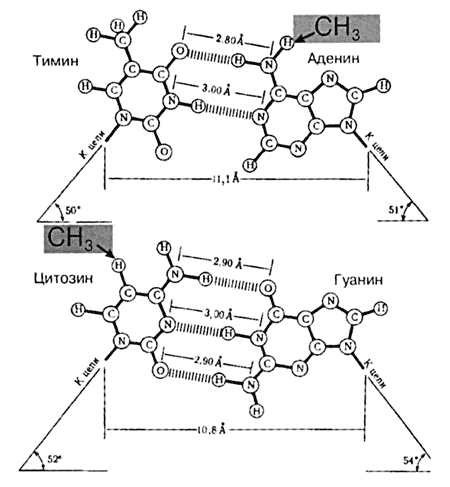
Рис. 2 Канонические уотсон-криковские (WC) пары оснований в ДНК. Стрелками показаны места, куда привносятся метилъные группы. | Уже более полувека известно, что наряду с классическими четырьмя основаниями (аденин, гуанин, цитозин и тимин) в ДНК могут встречаться необычные метилированные основания 5-метилцитозин( m5C ) и N6-метиладенин ( m6A ), получившие название минорных. Мы не знаем, сколько крови попортили эти миноры авторам двойной спирали в то время они уже были найдены в ДНК, но было непонятно, откуда они берутся. Лишь в 1961 году у бактерий, а затем у эукариот обнаружили ферменты, которые в присутствии донора метильных группS-аденозилметионина избирательно метилируют отдельные остатки цитозина или аденина в цепях ДНК. Стало ясно, что минорные основания не встраиваются в ДНК в готовом виде, а возникают в результате энзиматической модификации (метилирования) обычных оснований в уже сформированных или формирующихся цепях (рис 2). Однако долгое время оставалось неясным, зачем это нужно клетке и почему модифицируются не все, а только некоторые аденины и цитозины.
И у нас, и за рубежом принято было считать, что эти минорные основания не играют существенной роли ни в структуре ДНК, ни в её функционировании. В качестве доказательства привлекали излюбленный объект классических генетиков - плодовую мушку дрозофилу. В геноме этого насекомого долго никому не удавалось найти минорные основания. Это давало повод глубокоуважаемым столпам генетики (их имена я намеренно не упоминаю) утверждать, что если дрозофила прекрасно живёт без метилирования ДНК, то эта модификация генома вообще не должна иметь значения в жизнедеятельности эукариотических организмов. Долгие годы это заметно охлаждало интерес к метилированию ДНК у многих блестящих биохимиков и молекулярных биологов мира - и позволило нам в более или менее спокойной обстановке шаг за шагом идти по пути исследования метилирования ДНК.
Подобно великому русскому учёному И.П. Павлову, поставившему памятник собаке, и мне следовало бы отлить памятник дрозофиле (из-занебольших размеров мушки это было бы значительно дешевле). И не только потому, что она служила и служит бесценным биологическим объектом, а потому, что она позволила мне, моим коллегам и ученикам работать без присущего нашему времени ажиотажа и головокружительной гонки. Кстати, сейчас доказано, что и у дрозофилы ДНК метилирована и эта модификация генома важна для развития насекомого.
Мы всегда были убеждены в том, что минорные основания в ДНК и сама эта энзиматическая модификация генома обязательно должны сказываться на биологических функциях генома. „Если звёзды зажигают, значит, это кому-то нужно".
Физика, органическая химия, энзимология…
Для начала несколько слов о влиянии метилирования на структуру ДНК. Нам удалось найти такую необычную природную двутяжевую ДНК(у бактериофага AR9 Bacillus brews ), в которой вместо обычного для ДНК тимина присутствует характерное для РНК основание урацил. Грубо говоря, урацил - тот же тимин, но без метильной группы. Урацилсодержащая ДНК бактериофага плавилась (денатурировала) при гораздо более низкой температуре, чем идентичная ей по составу нормальная, тиминсодержащая ДНК. Стало ясно, что метилирование остатков цитозина небезразлично для самой структуры ДНК: оно стабилизирует двутяжевую спираль.
Ещё сильней привлекло нас то, что метилирование ДНК ощутимо сказывается на её взаимодействии (связывании) с различными белками. Во многих случаях метилирование по цитозиновым остаткам препятствует связыванию специфично реагирующих с ДНК ядерных белков(факторов), которые, собственно, и осуществляют разные генетические процессы, в том числе транскрипцию, репликацию и репарацию. С другой стороны, теперь уже известны и так называемые m5C -связывающие белки, которые, присоединившись в метилированных участках к ДНК, специфично аранжируют на ней весь ансамбль сложных белковых комплексов, контролирующих экспрессию генов. Слово „аранжировать" молекулярные биологи употребляют примерно в том же смысле, что музыканты и составители букетов: в основном сохраняя содержание и варьируя форму, изменять смысл и характер действия. Вот вам и „не играет роли"…
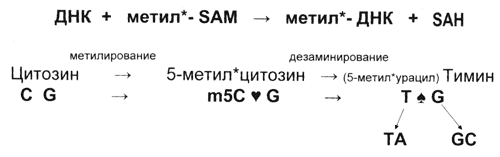
Рис. 3 Неэнзиматическое метилирование ДНК. Когда цитозин превращается в метилцитозин, „любовь" между ним и гуанином становится ещё крепче (♥), но после дезаминирования и возникновения тимина на смену „любви" приходит „пиковый интерес" - основания больше не спарены. Это приводит к замене пары CG на пару ТА, то есть к мутации | А если без всяких белков взять да проинкубировать ДНК с меченым по метильной группе S-аденозилметионином(донором метильных групп), то через некоторое время радиоктивность обнаруживается уже в составе ДНК в виде вновь возникших в ней остатков 5-метилцитозина и тимина (рис. 3). Так было открыто неферментативное метилирование ДНК. Интересно, что меченый тимин в ДНК обнаруживался при этом в гораздо более заметных количествах, чем m5C . Тем самым было выявлено, что неэнзиматическое метилирование ДНК в водном растворе сопровождается быстрым окислительным дезаминированием возникших остатков m5C с превращением их в остатки тимина. Это доказывало, что метилирование остатков цитозина в ДНК может приводить к С→Т-транзиции(в результате чего пара GC превратится в пару AT), следовательно, остатки 5-метилцитозина - горячие мутационные точки. Это явление лежит в основе широко распространённого исчезновения (супрессии) некоторых ( CpG )-последовательностейиз генов и геномов разнообразных организмов. Супрессия CpG - один из магистральных путей природного мутагенеза и эволюции.
Коль скоро метилирование ДНК возможно, по-видимому, оно и было использовано появившимися в эволюции ферментамиДНК-метилтрансферазами. Эти ферменты умеют метилировать цитозиновые или адениновые остатки не хаотично, как в предыдущем случае, а в строго определённых последовательностях. Далее эти ферменты я буду называть просто ДНК-метилазами.
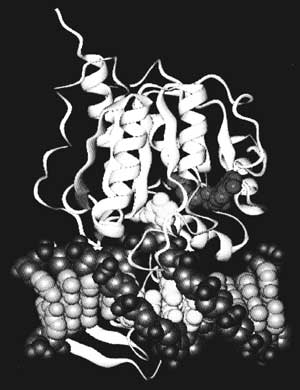
Рис. 4 Комплекс фермента цитозиновойДНК-метилтрансферазы с ДНК. | На рис. 4 можно видеть, как лихо одна из бактериальных ДНК-метилаз расправляется с ДНК. Сначала фермент узнаёт подходящий участок ДНК, в этом месте ковалентно связывается с ней и буквально выворачивает цитозин наружу двойной спирали, насаживая на него метильную группу. Затем фермент отщепляется и модифицированное основание возвращается на место. Все эти подробности стали известны недавно благодаря блестящему рентгеноструктурному исследованию кристаллов ДНК-фермент нашими американскими коллегами (Айра Шильдкраути другие). В своё время мы расшифровали одну из самых первых таких последовательностей ДНК у бактерий. Оказалось, что в клетках Bac. brewis ДНК-метилаза метилирует цитозиновые остатки в последовательности (5’) N’ G C T G С N… (3’). (Подчёркнут остаток, подвергающийся метилированию.) Позднее это было подтверждено в работах нобелевского лауреата Р. Робертса.
Метилирование ДНК у бактерий лежит в основе явления так называемой хозяйскойрестрикции-модификации. Бактериофаг, выращенный в клетках того или иного штамма бактерии, приобретает хозяйскую специфичность: он способен заражать только клетки этого штамма, поскольку ДНК бактериофага обработана ДНК-метилазами бактерии-хозяина и тем самым защищена от расщепления хозяйскими ферментами эндонуклеазами. Мы установили, что метилирование адениновых остатков у бактериофага Т2 и его хозяина E. coli действительно идёт в одних и тех же последовательностях (это и значило, что над ДНК бактерии и фага, скорее всего, потрудился один и тот же фермент). Ещё до этого мы убедились в том, что ДНК у разных бактерий метилирована по-разному, то есть была установлена штаммовая специфичность её метилирования.
Это было только самое начало. Предстояло ещё выяснить, какова химическая и биологическая специфичность метилирования ДНК у эукариотических организмов, в том числе у растений и животных.
О старении, раке и не только

Рис. 5 Химическая (сайтовая) специфичность метилирования цитозина в ДНК эукариот. | Практически одновременно с А. Разиным (Израиль) мы установили, что в ДНК эукариот метилируются цитозиновые остатки в двух типах симметричных последовательностей - CG и CNG (здесь N - любой нуклеотид) (рис. 5). Тем самым была установлена природа химической специфичности метилирования ДНК у растений и животных. Что касается биологической специфичности метилирования ДНК эукариот, то мы уже знали, что оно неодинаково у разных видов. У некоторых беспозвоночных степень метилирования генома очень мала, например, у дрозофилы, как мы уже говорили, 5-метилцитозин долгое время вообще не могли обнаружить, а у позвоночных в ДНК он всегда выявляется в ощутимых количествах. В ДНК растений его уже вовсе нельзя назвать „минорным" основанием: часто по количеству он вполне сопоставим с цитозином (табл. 1). Кроме того, мы открыли тканевую (клеточную), субклеточную (органоидную) и возрастную разнокачественность метилирования ДНК у растений и животных.
| Мол. % |
| |
5-метилцитозин |
N6-метиладенин |
| Вирусы (бактериофаги) |
+ |
+ |
| Бактерии |
0,01-1,53 |
0,02-0,70 |
| Водоросли |
0,20-3,50 |
0,10-0,60 |
| Грибы |
+ |
0-0,5 |
| Простейшие |
|
0,3-1,0 |
| Растения |
2,0-10,0 |
0,3-1,0 |
| Беспозвоночные |
0,1-2,5 |
? |
| Позвоночные |
0,7-3,5 |
+ | Табл. 1 Содержание минорных оснований в ДНК
Здесь будет уместно привести признание одного из наших американских коллег, Крейга Куни, плодотворно работающего в этой области знания и написавшего книгу „Магический метил" (Craig Cooney, „Methyl Magic", Andrews McMeel Pubhsmg, USA, 1999). „Русские показали, что метилирование ДНК у животных уменьшается с возрастом. Это было интригующим указанием на то, что старение и уменьшение метилирования ДНК идут рука об руку. Означает ли это, что существует связь между старением клеток и уменьшением уровня метилирования ДНК? Скорее всего, да. Борис Ванюшин и его сотрудники в Москве первыми показали ещё в 1960 годах и опубликовали в 1967 году, что у горбуши уровень метилирования ДНК уменьшается с возрастом. Они же показали, что это происходит также и в большинстве органов у стареющих коров и крыс. Позднее несколько групп учёных в США и Японии обнаружили, что и у мышей при старении также уменьшается метилирование ДНК".
Теперь возрастное деметилирование ДНК стало вполне очевидным фактом, и некоторые исследователи даже склонны считать, что степень метилирования ДНК может служить биологическими часами, по которым возможно судить о возрасте и прогнозировать продолжительность жизни. Не исключено, что искажение метилирования ДНК приводит к преждевременному старению. Об этом надо помнить и, по крайней мере, не допускать в еде обычного у нас дефицита фолиевой кислоты и витамина В12, которые, как известно, участвуют в образовании аминокислоты метионина - донора метильных групп в клетке.
Мы обнаружили, что в разных клетках одного и того же организма ДНК метилирована по-разному. Это позволило нам в 1970 году первыми заявить в журнале „Nature" о том, что метилирование ДНК регулирует экспрессию генов и клеточную дифференцировку. Наши работы привлекли внимание многих учёных у нас и за рубежом и послужили толчком к интенсивному исследованию метилирования ДНК в мире.
Между тем мы продолжали разбираться с метилированием ДНК почти „в гордом одиночестве". В последующие 10 лет мы установили, что даже в митохондриях и ядре одной и той же клетки ДНК метилированы по-разному. Оказалось, что характер распределения 5-метилцитозинапо пиримидиновым блокам в митохондриальной и ядерной ДНК быка различен. Мы выделили цитозиновую ДНК-метилазу из митохондрий быка и показали, что этот фермент метилирует цитозиновые остатки не в тех местах (последовательностях), что ядерный. Так в 1976 году была открыта субклеточная - органелльная специфичность метилирования.
Поскольку мы волей судеб оказались одними из первых, кто задался вопросом о роли метилирования ДНК, нам же пришлось и выбирать для работы биологические модели. Мы исходили из принципа, что если метилирование ДНК имеет какие-либо биологические функции, то оно само, скорее всего, не может оставаться равнодушным к этим функциям и должно специфично изменяться при их индукции. Так мы пришли к моделям „гидрокортизон - печень" и „обучение (память) - нейрон".
Действительно, оказалось, что после введения животному гидрокортизона в его печени сильно изменяется характер метилирования ДНК и при этом активируются разные гены. Как мы показали в 1977 году, изменяется характер метилирования и в нейронах (но не в других клетках мозга)при обучении - это было одно из первых указаний на участие генома в формировании памяти. У растений метилирование ДНК сильно изменяется при прорастании семян, при переходе к цветению и после заражения разными грибами и вирусами. Стало понятно, что инфекционные агенты могут тонко воздействовать на организм, подчиняя его своим „прихотям" путем модуляции метилирования хозяйской ДНК.
„Ещё в 1977 году русские сравнили характер метилирования ДНК в клетках крови у нормальных и больных лимфолейкозом коров. В целом уровень метилирования ДНК у животных, больных этим видом рака крови, оказался ниже" (Craig Cooney, „Methyl Magic", Andrews McMeel Pubhsmg, USA, 1999, p.44.).
Мы показали, что на фоне очень высокой ДНК-метилазной активности (то есть ферменты у больных животных были активнее, чем у здоровых) ДНК в лейкозных клетках по сравнению с нормальными в целом метилирована меньше, но палиндромные последовательности (перевертыши) в этой ДНК, напротив, метилированы сильнее. При раковом перерождении клеток и тканей, гормональной индукции и старении у млекопитающих также изменяется метилирование повторяющихся последовательностей, причём в разных тканях по-разному. В 1978 году Н.Н. Бурцева в нашей лаборатории нашла в ядрах лимфоцитов у лейкозных коров по крайней мере две ДНК-метилазы, одна из которых резко отличалась по сайтовой специфичности от ферментов из клеток здоровых коров.
Всё это позволило нам заявить, что нарушение метилирования ДНК - верный путь к раку. Теперь это стало общепризнанной истиной, получило подтверждение и развитие в работах С. Бейлина, П. Джонса, Р. Ениша (США) и других, а сведения о характере метилирования генов используют как ранний диагностический признак рака.
Меня часто спрашивают, что лучше: сильно или слабо метилированная ДНК? Мой ответ - ни то и ни другое: она должна быть метилирована нормально. Когда мой коллега из Национального токсикологического центра США Лайонел Пуарье исключает из рациона аминокислоту метионин (источник метильных групп), у всех подопытных крыс через две недели неотвратимо развивается рак печени - гепатома. Но рак развивается и в том случае, когда у трансгенных мышей активирован ген человеческой ДНК-метилазы, что приводит к суперметилированию генома! В результате нокаута одного из генов ДНК-метилаз останавливается развитие эмбрионов шпорцевой лягушки и включается запрограммированная гибель клеток (апоптоз). Как ни крути, к метилированию ДНК нужно относиться с уважением и осторожностью.
К счастью, клетки могут регулировать этот эпигенетический сигнал. Как уже упоминалось, метилирование ДНК у животных контролируется гидрокортизоном. По нашим данным, его также модулируют антиоксиданты. Г.А. Романову в 1979 году удалось показать, что высокоочищенныедексаметазон-рецепторные комплексы из печени крысы специфично связываются с GC-обогащёнными участками ДНК: этот самый первый намёк на то, что в ДНК есть особые сайты связывания гормон-рецепторных коплексов (ГРК), оказался сюрпризом даже для отцов „империи гормонов" Джона Бакстера и Берта О’Мелли (США). Мы установили, что метилирование ядерной ДНК печени крысы ДНК-метилазойпрепятствует связыванию с ней гормон-рецепторных комплексов - ДНК становится „глухой" к призывам гормонов.
Растения также умеют управлять метилированием ДНК. В частности, нашими работами установлено, что под действием фитогормонов заметно уменьшается глобальное метилирование ДНК в клеточном цикле растений.
Так что же с наследованием?
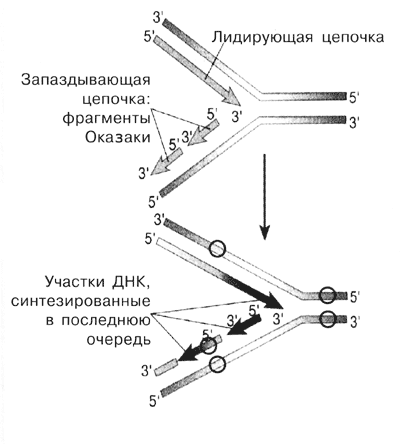
Рис. 6 Репликация ДНК (кружками обозначены метильныегруппы) | Вопрос о том, когда и в какой степени метилируются ДНК в клеточном цикле у растений и животных, нас интересовал в особенности. Известно, что синтез одной из цепей ДНК при репликации двутяжевых ДНК происходит непрерывно, а другой - прерывисто, с образованием относительно коротких фрагментов, которые затем сшиваются в одну непрерывную цепь (рис. 6). Мы задались целью выделить эти фрагменты и выяснить, метилированы ли они или нет. Оказалось, что при выращивании растительных и животных клеток в культуре, когда их концентрация в среде высока, синтез одной из цепей ДНК ограничивается образованием коротких фрагментов: лигирования (сшивания)не происходит. Эти фрагменты нам удалось получить в ощутимых количествах и изучить их метилирование. Они на самом деле представляли собой фрагменты, описанные японским учёным Оказаки. Так вот, мы выяснили, что фрагменты Оказаки метилированы как у животных, так и у растений - следовательно, метилирование начинается уже при „рождении" ДНК.
Но кроме этого, мы установили, что по степени и специфичности метилирования фрагменты Оказаки отличаются от лигированных интермедиатов репликации и от зрелой ДНК. В отличие от лигированной ДНК метилирование фрагментов Оказаки устойчиво к действию различных ингибиторов и не подавляется гормонами (ауксины у растений). Мы пришли к выводу, что в ядре имеется несколько ДНК-метилаз, которые обслуживают ДНК на разных стадиях репликации. Это полностью согласуется с современными данными.
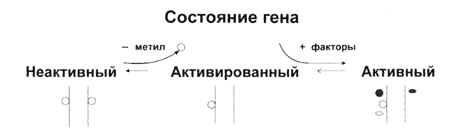
Рис. 7 Состояние генов и их активация путем уменьшения метилирования. | Вместе с М.Д. Кирносом и Н.И. Александрушкиной мы предложили и описали новый механизм природной регуляции репликации с помощью метилирования. Установлено, что в результате репликации у растений образуются полуметилированные дуплексы ДНК (как на рис. 7): одна цепь метилирована значительно сильнее другой. Эта асимметрия цепей уменьшается к концу клеточного цикла, и перед новой репликацией полуметилированные сайты становятся полностью метилированными. Репликация полуметилированных ДНК в клетке, по-видимому,запрещена, так как она привела бы к утрате эпигенетического сигнала. Много позже было показано, что такая регуляция репликации реализуется у бактерий.
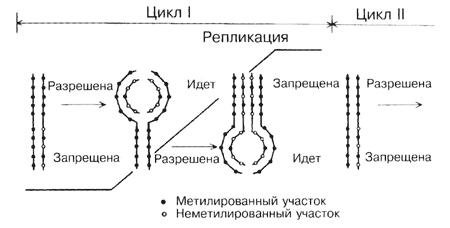
Рис. 8 Регуляция метилированием репликации ДНК в клеточном цикле. | Теперь стало более или менее понятным, как именно эпигенетический сигнал (характер метилирования) передаётся по наследству. При репликации возникают полуметилированные ДНК (как на рис. 8). В таком состоянии (рис. 7), по-видимому, и работает большинство генов в интерфазном ядре, то есть в течение всей жизни клетки между делениями. Перед очередным раундом репликации генома и делением клетки особые ДНК-метилазы, задача которых - поддерживать статус метилирования (их так и называют: поддерживающего типа), превращают полуметилированные сайты в полностью метилированные.5-метилцитозин в одной цепи служит отличительным признаком и условием для метилирования цитозинового остатка в комплементарной цепи. После этого гены инактивируются (с нихбольше не считывается РНК), и разрешена репликация ДНК (рис. 7, 8).
Таким образом, характер метилирования ДНК наследуется! И это доказано уже многими опытами. Например, установлено, что обработка растений ингибитором метилирования ДНК - 5-азацитидином -приводит к наследуемому в нескольких поколениях сильному (иногда более чем на 30%) увеличению белковости зерна. Такое и не снилось генетикам и селекционерам. Обычно гены запасных белков сильно зарепрессированы, для прорастания и начального развития растения вполне достаточно того количества запасного белка, которое синтезируется при работе генов „вполсилы". Под действием 5-азацитидина ДНК деметилируется, и эти гены экспрессируются гораздо интенсивнее. Растению в принципе это и не нужно, зато нам - большая выгода: зерно, хлебушко наш насущный, особенно ценно для нас белком, а крахмал мы из картошки получим.
Не исключено, что неправильный, искажённый характер метилирования ДНК иногда наследуется прочно или даже навсегда. В одних случаях это может быть благом, а в других - большим злом, горем, наследственными болезнями. Однако клетка всегда стремится вернуться к исходному, правильному „портрету" модификации её генома, и у неё существуют особые тонкие механизмы для поправки таких ударов судьбы и среды. К сожалению, мы ещё очень мало знаем об этих премудростях живого.
Как бы то ни было, сегодня доподлинно известно, что метилирование ДНК в клетке - не пустяк, оно контролирует все генетические процессы, в том числе такие, как транскрипция, репликация, рекомбинация, транспозиция генов, репарация, инактивация Х-хромосомы (половаядифференцировка). Неудивительно, что к изучению этой небольшой энзиматической модификации генома приковано внимание многих исследователей.
Здесь речь шла лишь о метилировании цитозиновых остатов в ДНК. Недавно нам удалось показать, что у эукариот геном метилируется и по адениновым остаткам. А это ещё зачем? Пока мы не знаем ответа, но предполагаем, что эта модификация также контролирует репликацию ДНК, а может быть, как у бактерий, она регулирует и экспрессию генов. Пока мы держим в руках лишь один из растительных ферментов, который метилирует адениновый остаток (внутренний А в последовательности TGATCA, предпочтительно у однотяжевых ДНК). По-видимому, этот фермент участвует в контроле за репликацией митохондриальных ДНК.
Что день грядущий нам готовит?
Думается, очень нелёгкую научную жизнь, сулящую новые поиски и находки, горечь неудач и неописуемую радость познания.
Мы постарались здесь рассказать всего лишь об одном из эпигенетических сигналов, который затрагивает структуру ДНК и наследуется, но не закодирован непосредственно в геноме. Очень хочется принести извинения за частое упоминание наших работ. Такова уж судьба и роль первопроходцев; наряду с отрицанием по принципу „этого не может быть, потому что не может быть никогда" всё же иногда приходит и заслуженное признание. В юбилейном для ДНК 2003 году цикл этих работ был отмечен в МГУ первой премией имени М.В. Ломоносова. Сразу же подчеркну, что эти исследования начаты вместе с моим учителем академиком А.Н. Белозерским и все они неразрывно связаны с его именем и с памятью об этом выдающемся учёном и удивительном, богатом душой и сердцем человеке.
После того как была раскрыта исключительная роль метилирования ДНК в жизни организмов, по сути дела, впервые произошла и материализация самой эпигенетики как отрасли знания, науки. Уверен, что в клетке имеются и другие системы эпигенетических сигналов, их много и они разнообразны. Важная роль в некоторых из них должна принадлежать не ДНК, а белкам, в том числе белкам хроматина. Говорят даже о „гистоновом коде". (Гистоны - белки, которые участвуют в структурировании хроматина - укладке нити ДНК в компактную хромосому. Часто их модификации „туда и обратно" - метилирование, фосфорилирование, ацетилирование, убиквитинирование без приставки „де" или с ней - определяют, будут ли гены активными или нет.) А ведь есть ещё и множество негистоновых регуляторных белков, формирующих затейливые комплексы на ДНК, которые замалчивают гены или, напротив, запускают их в работу. Мы - на пороге расшифровки и этих любопытных сигналов. Однако это уже отдельная песня…
В начале статьи я упомянул, что век двадцатый был веком торжества генетики. Нет сомнений в том, что век нынешний по праву - век эпигенетики.
|









