
|
|
 |
|||||||||
| |||||||||
|
Возрастзависимая модификация гистонов
В данном материале рассмотрены вопросы возрастзависимого ацетилирования, фосфорилирования, метилирования, убиквитинирования, сумоилирования гистонов хроматина Немного о гистонах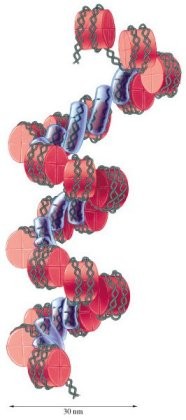 Молекула ДНК огромна. Трудно себе представить, но в каждой клетке человеческого организма содержится ДНК длиной приблизительно 2м. Для того, чтобы уместить такое количество генетической информации необходима упаковка ДНК в хромосомы. Она осуществляется в том числе и с помощью гистонов. Молекула ДНК огромна. Трудно себе представить, но в каждой клетке человеческого организма содержится ДНК длиной приблизительно 2м. Для того, чтобы уместить такое количество генетической информации необходима упаковка ДНК в хромосомы. Она осуществляется в том числе и с помощью гистонов.Гистоны- это нуклеопротеины, основная составляющая хроматина. Известно 5 классов гистонов: H1, H2A, H2B, H3 и H4. Гистоны- эволюционно-консервативные белки, все они имеют структурный мотив "спираль поворот спираль поворот спираль" (трехспирального домена), что способствует их димеризации. Каждый из них имеет 2 аминокислотных "хвоста", которые являются мишенью для последующей эпигенетической модификации и регуляции. H2A, H2B, H3 и H4 формируют core - гистоновый октамер, структуру из 8 молекул гистонов (тетрамер (Н3)2-(Н4)2 и два димера Н2А-Н2В ), на которую наматывается ДНК. H1 (Linker histone) способствует правильному наматыванию ДНК на кор. 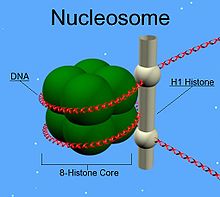 Каждая нуклеосома состоит из H2A-H2B-димера и H3-H4-тетрамера. На одну нуклеосому(гистоновый октамер, обмотанный нитью ДНК) приходится 146 парнуклеотидов ДНК, оплетающей нуклеосому в виде лево-закрученной спирали. В дальнейшем "бусы" из нуклеосом сворачиваются, в конце концов образуя хромосому. Каждая нуклеосома состоит из H2A-H2B-димера и H3-H4-тетрамера. На одну нуклеосому(гистоновый октамер, обмотанный нитью ДНК) приходится 146 парнуклеотидов ДНК, оплетающей нуклеосому в виде лево-закрученной спирали. В дальнейшем "бусы" из нуклеосом сворачиваются, в конце концов образуя хромосому. Взаимодействие ДНК и гистонов. Функции гистонов Гистоны, образуя нуклеосому, вступают во взаимодействие с ДНК: Гистоны, образуя нуклеосому, вступают во взаимодействие с ДНК:1) положительно заряженные спирали H2B, H3, и H4 взаимодействуют с отрицательно заряженными фосфатными группами молекулы ДНК 2) Водородные связи между остовом ДНК иамидными группами цепей гистонов 3) Неполярные связи между гистонами идезоксирибозой ДНК 4) Водородные связи между боковыми цепями основных аминокислот гистонов (в основном лизинаи аргинина) и кислородом фосфатных групп ДНК 5) Неспецифическое взаимодействие N-концевых "хвостов" H3 и H2B гистонов с малой бороздкой молекулы ДНК. Взаимодействуя с ДНК, гистоны выполняют свои функции. Кроме рассмотренной выше структурной функции (участие в компактизации), гистоныучаствуют в регуляции активности генов,репликации, репарации, рекомбинации ДНК. Гистоны подвергаются посттрансляционной модификации, что изменяет их взаимодействие с ДНК и ядерными белками. В основном модифицируются "хвосты", но могут модифицироваться и основные части белков (H2A и H3). Комбинация модификаций составляет " гистоновый код ". Ацетилирование гистоновN- концевые "хвосты" гистонов содержат остатки аминокислоты лизина. Аминокислотная последовательность "хвостов", особенно местоположение остатков лизина, строго консервативна в эукариотических клетках, от дрожжей до человека. Лизин имеет положительно заряженную аминогруппу на эпсилон- атоме углерода (эпсилон- аминогруппа). Она ацетилируется гистоновой ацетилтрансферазой (HAT). Обратная реакция проходит под действием деацетилазы (HDA). Положительный заряд на амино- группе лизина взаимодействует с отрицательным зарядом фосфатных групп ДНК и отрицательно- заряженными фрагментами гистонового октамера. Нейтрализация основного заряда гистоновых "хвостов" ацетилированием снижает их сродство с ДНК и меняет гистон- гистоновые взаимодействия между соседними нуклеосомами, а также взаимодействия гистонов с др. регуляторными белками. Это делает возможной транскрипцию.  Активные гены обычно локализованы в гиперацетилированном хроматине, неактивные- в гипоацетилироанном. Транскрипционные факторы, активирующие транскрипцию, активируют HAT, факторы, ингибирующие (подабляющие) транскрипцию, активируют HDA.  При онкологических заболеваниях и некоторых вирусных инфекциях нарушается свойственный нормальной клетке баланс между ацетилированием и деацетилированием гистонов. Так,аденовирусный онкобелок Е1А ингибирует активность гистоновой ацетилтрансферазы, и, следовательно, гистоны остаются без ацетильной метки. В результате невозможно действие деацетилазы, а ведь от ее взаимодействия с определенным белком зависит подавление роста клеток раковой опухоли. Еще один пример касается ретинобластомного белка (RB), который в норме синтезируется в сетчатке и многих других тканях. Если ген этого белка поврежден, образуется измененный RB, неспособный связываться с транскрипционным комплексом, а тот, будучи без RB, не может взаимодействовать с гистоновой деацетилазой. В результате молчащие в нормальной клетке гены начинают работать, что и приводит к развитию онкологических заболеваний. Такой ход событий выявлен при многих раковых заболеваниях. Более того, некоторые вирусные онкобелки способны целенаправленно блокировать взаимодействие нормального ретинобластомного белка с гистоновой деацетилазой. В проблеме связи ацетилирования/деацетилирования гистонов и старения существует много неясного. Известно, что с возрастом снижается уровень ацетилирования гистонов, в частности H4 гистона. Также выявлено, что от уровня ацетилирования гистонов зависит уровень активности генов супероксиддисмутазы, а следовательно, и защита клетки от оксидативного стресса, который, согласно некоторым теориям, и является фактором старения. Все эти вопросы требуют детального изучения. Фосфорилирование гистоновФосфорилирование гистонов осуществляется по сериновым остаткам. Фосфорилирование серина10 гистона H3 коррелирует с активацией генов в клетках млекопитающих и с индукцией транскрипции во время шоковой реакции у Drosophila. Покоящиеся фибробласты, обработанныефактором роста эпидермиса, быстро фосфорилируются по серину 10, что совпадает с индукцией раннего ответа генов, таких как c-fos. Это фосфорилирование катализируется с помощью Rsk-2-киназы, а клетки от пациентов с Rsk-2-дефицитом (Coffin-Lowry Syndrome) не подвергаются фосфорилированию по серину 10 или индукции c-fos в ответ на фактор роста эпидермиса. Добавление негативно заряженных фосфатных групп в хвосты гистонов нейтрализует их базовый заряд и снижает их сродство к ДНК. Более того, некоторые ацетилтрансферазы обладают повышенной HAT- активностью на серин 10-фосфорилированном субстрате, а мутации серина 10 снижают активацию регулируемых Gcn5 генов (генов ацетилтрасферазы HAT). Таким образом, фосфорилирование может участвовать в активации транскрипции, стимулируя HAT активность того же самого гистонового "хвоста". Так, фосфоацетилирование гистона H3 влияет на процесс активации транскрипционных факторов c-fos- и c-jun, модифицируя тем самым экспрессию различных генов. Фосфорилирование H2A коррелирует с конденсацией митотических хромосом. Мутация серина 10 в гистонах Tetrahymena обусловливает аномальную конденсацию хромосом и неправильное разделение хромосом в анафазе митоза. Фосфорилирование H3 происходит после активации сигнального пути в ответ на повреждение ДНК. Например, эволюционно консервативный мотив (ASQE, in the single-letter amino-acid code) , обнаруживаемый на С-конце дрожжевого H2A и варианта H2A млекопитающих, H2A.X , быстро фосфорилируется в ответ на действие ДНК-повреждающего агента. Идентифицирован серин 139 как место для такой модификации, его фосфорилирование в ответ на повреждение зависит от фосфатидилинозитол-3-OH киназы Mec1 у дрожжей. Mec1-зависимое фосфорилирование серина 139, по-видимому, необходимо для эффективной негомологичной репарации ДНК.
Метилирование гистоновИзвестно, что интенсивность метилирования гистонов меняется в течении клеточного цикла. Метилирование гистонов наблюдается во время перехода клеток из S в G2 - фазу. В период митоза происходит также метилирование богатых аргинином гистонов, что свидетельствует о наличии корреляции между метилированием белков хроматина и скоростью роста клеток. При этом необходимо подчеркнуть, что метилтрансферазы зрелых, эмбриональных и неопластических тканей имеют различную активность. Эти данные являются подтверждением того, что метилирование принимает участие в процессах дифференциации клеток, а метилирование белков хроматина является одним из параметров, которые характеризуют функциональное состояние клетки. Модификации гистонов могут служить как cis-действующие связывающие места для вспомогательных факторов, таких как гетерохроматиновый белок 1, который связывается с гистоном H3 за счет метилирования по остатку лизина 9, что является основным биомолекулярным взаимодействием в гетерохроматине и контролируется Suv39h1 и Suv39h2гистоновой метилтрансферазой. Метилирование гистонов также происходит в гистоне H3 в позиции лизина 4, но в этом случае метилирование коррелирует с транскрипционной активностью. Сама ДНК может метилироваться в основном по остаткам цитозина в CpG динуклеотидах. Здесь также метилирование способствует биомолекулярным взаимодействиям между гетрохроматином и вспомогательными белками, такими, как MeCP2, and MBD1, 2 и 3(Писаржевский). Таким образом, метилирование лизина 9 в гистоне-3 и метилирование ДНК взаимозависимы. Иными словами, СН3-модификация ДНК определяется ее эпигенетическим выключением (т.е. метилированием гистоновых "хвостов") в составе хроматина (Карпов, 2005).Выключение генов, продукты которых подавляют раковые опухоли, и активация генов, необходимых для их роста, происходят одновременно. Расшифровка специфического эпигенетического "ракового кода" и "кода старения" на уровне метилирования ДНК имеет огромное практическое значение и уже сейчас может использоваться для диагностики онкологических заболеваний. Более того, правильно подобрав препараты, в идеале можно изменить "раковый код" и вернуть клетку к нормальному состоянию. 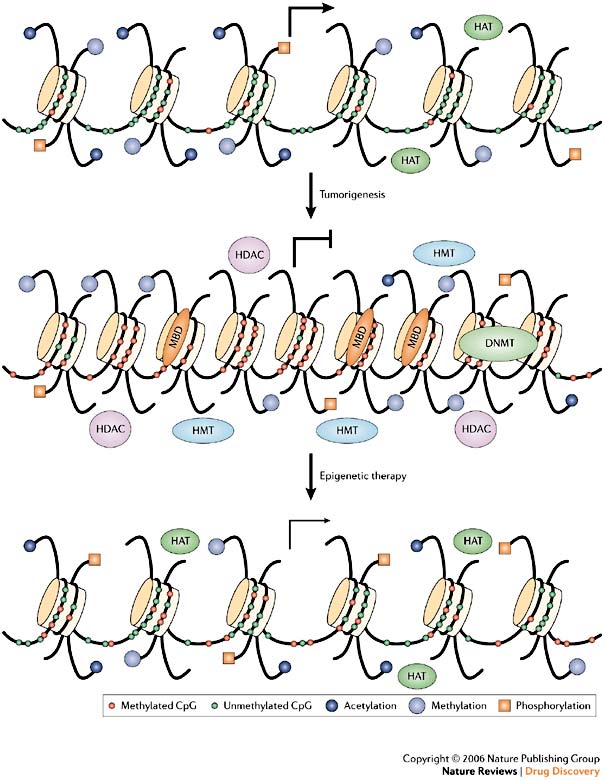 Для того, чтобы решить эти задачи, необходимо точно определить сайты метилирования и соответствующие им метилтрансферазы, механизмы функционирования метилтрансфераз. Убиквитинирование гистоновУбиквитинирование- присоединение к белку небольшого белка убиквитина с помощью убиквитин-лигаз, осуществляется посттрансляционно для инициирования деградации, а также для регуляции локализации и функционирования белка. Потеря сайтов убиквитинирования приводит к дефектам мейоза и митоза.
Убиквитинирование H2A и H2B гистонов имеет важнейшее значение для внутриклеточных процессов- инициации и элонгации транскрипции, инактивации генов и репарации ДНК. Кроме того, убиквитинирование гистонов влияет и на другие их модификации: Сумоилирование гистоновСумоилирование схоже с убиквитинированием, оно представляет собой присоединение небольших убиквитин-подобных белков (Small Ubiquitin-like Modifier -SUMO). Также, как и убиквитинирование, сумоилирование важно для многих внутриклеточных процессов- внутриклеточном транспорте, регуляции транскрипции, апоптозе, ответе на стресс и прохождении клеточного цикла. В отличие от убиквитина, SUMO не направляют белок на деградацию. Сейчас исследуется связь между сумоилированием гистонов и канцерогенезом, обсуждаются перспективы создания лекарств против рака, эффект которых основывается на воздействии на системы модификации гистонов, в том числе сумоилироание.  В лаборатории под руководством Филипа Брантона в McGill University,Montréal проводятся исследования связи сумоилирования гистонов с процессами старения и канцерогенеза. Было выяснено, что RBP1 (белок, ассоциированный с ретинобластомой) подавляет транскрипцию и клеточный рост (процессы, схожие со старением) , изменяя сумоилирование гистонов. В лаборатории под руководством Филипа Брантона в McGill University,Montréal проводятся исследования связи сумоилирования гистонов с процессами старения и канцерогенеза. Было выяснено, что RBP1 (белок, ассоциированный с ретинобластомой) подавляет транскрипцию и клеточный рост (процессы, схожие со старением) , изменяя сумоилирование гистонов.В заключениеМодификации гистонов играют огромную роль в регуляции экспрессии генов, а следовательно, во всех внутриклеточных процессах. При нарушении процессов модификации изменяется экспрессия генов, что ведет за собой развитие различных заболеваний и старение. Эти вопросы еще недостаточно исследованы. внимание основной части ученых сконцентрировано на ацетилировании гистонов, тогда как другие, не менее важные процессы, вниманием обделены. Перспективы исследований огромны, потому что 21 век-это не столько век генетики, а в ек эпигенетики- изучения регуляции экспрессии генов . Возможно в будущем будут созданы лекарства от рака, мишенью которых будут ферменты, модифицирующие гистоны. Пора переходить от слов к действиям...Есть несколько вопросов, на которые необходимо ответить: 1) Как повлиять на ацетилирование гистонов для защиты от оксидативного стресса и старения? 2) Как повлиять на ацетилирование гистонов для борьбы с онкологическими заболеваниями? 3) Каков точный механизм участия фосфорилирования гистонов в возникновении онкологических заболеваний и старении? 4) Расшифровка специфического "ракового кода" и "кода старения" на уровне метилирования гистонов. 5) Подробности механизма убиквитинирования гистонов. 6) Как именно убиквитинирование связано с онкологическими и возрастассоциированными заболеваниями? 7) Как убиквитинирование гистонов участвует в процессе старения? 8) Как происходит сумоилирование гистонов? 9) Как сумоилирование связано с процессом старения? 10) Какова роль сумоилирования в возникновении онкологических заболеваний? 11) Как можно повлиять на механизмы модификации гистонов с целью достижения терапевтического эффекта при лечении возрастассоциированных заболеваний?
|
Дизайн и поддержка: Interface Ltd. |
|